
- •Лекция №1
- •Элементы химической термодинамики, термодинамики растворов
- •И химической кинетики
- •Значение химии в медицине
- •1.2. Основные термины и положения термодинамики
- •1.3. Общие сведения о равновесной термодинамике
- •1.3.1. Первое начало термодинамики. Энтальпия.
- •1.3.2. Второе начало термодинамики
- •Энтропия
- •1.3.3. Третье начало термодинамики
- •1.5. «Всеобщий закон биологии» Бауэра
- •Особенности живых организмов с позиции термодинамики
- •Химическое равновесие
- •Влияние внешних факторов на химическое равновесие.
- •Химическая кинетика и катализ
- •Катализ
- •Теории гетерогенного катализа
- •Микрогетерогенный катализ
Катализ
Скорость химических реакций может возрастать не только при увеличении концентрации реагирующих веществ или температуры системы, но и под влиянием катализаторов.
Вещества, которые увеличивают скорость химической реакции, оставаясь в конечном итоге неизменными по химическому составу и количеству, называют катализаторами.
Процесс увеличения скорости реакции с помощью катализатора называется катализом, а реакции, в которых скорость изменяется в результате введения в реакционную смесь катализаторов, называются каталитическими.
Особенности катализаторов:
Ускоряют реакцию, присутствуя в очень малых количествах
Избирательность действия, то есть катализатор ускоряет одну реакцию и неэффективен для другой. Особенно это свойство проявляется у биологических катализаторов-ферментов
Неизменность после реакции и возможность многократного использования
Катализатор изменяет механизм реакции и направляет ее по такому пути, который характеризуется понижением энергии активации.
В зависимости от того, находится ли катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, различают гомогенный и гетерогенный катализ.
Гомогенными катализаторами обычно могут быть растворы кислот, оснований, солей (прежде всего d-элементов— Сr, Mn, Fe, Со, Ni и др.). Примером гомогенного катализа может служить каталитическое разложение пероксида водорода в водном растворе на воду и кислород в присутствии ионов Cr2O72- , WO42- , МоО42- .
При гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах и разделены между собой поверхностью раздела (в качестве примера можно привести окисление SO2, до SO3 в присутствии катализатора, находящегося в твердой фазе). Катализаторы отличаются избирательностью, что зависит не только от природы катализатора, но условий его применения.
Механизм действия катализатора различен. Наиболее часто встречается катализ, при котором катализатор ускоряет скорость взаимодействия за счет образования промежуточных соединений. При взаимодействии этих продуктов высвобождается катализатор, количество которого остается неизменным.
Процесс образования промежуточных соединений с участием катализаторов является примером гомогенного катализа. В общем виде процесс выглядит следующим образом: А+В К АВ.
Из-за высокой энергии активации скорость реакции вещества А с В без катализатора ничтожно мала. Допустим, что катализатор легче реагирует с веществом А, чем исходные А и В между собой: A + K = AK
Возможность такого взаимодействия можно объяснить более низкой энергией активации при образовании АК. Промежуточный продукт АК, в свою очередь, легко реагирует с веществом В из-за иной природы веществ и малой энергии активации: AK + B = AB + K.
Таким образом, роль катализатора сводится к снижению энергии активации.
Биохимические реакции в растениях и животном организме ускоряются биологическими катализаторами, называемыми ферментами (энзимами). Они представляют собой либо высокомолекулярные белки, либо сочетание белков с соединениями небелковой природы. Каждый фермент характеризуется высокой избирательностью по отношению к каждому конкретному процессу. Если учесть, что в организме человека протекает более 10 000 различных биохимических процессов, то понятно, насколько велика роль ферментов. Например, окисление сахара в организме протекает примерно в 106 раз быстрее, чем при той же температуре в водном растворе под влиянием кислорода. В сложной цепи биохимических процессов окисления сахара в организме участвует несколько ферментов, каждый из которых катализирует отдельную стадию.
Катализом называют явления изменения скорости реакции или возбуждение, происходящее под действием некоторых веществ, называемых «катализаторами», которые, участвуя в процессе, сами в конце реакции остаются химически неизменными.
Различают катализ гомогенный (катализатор находится в той же фазе, что и реагирующие вещества; 2) гетерогенный катализатор и реагирующие молекулы находятся в разных фазах. Реакции, которые каталитически ускоряются продуктами, называются автокаталитическими. Положительный катализ: катализатор ускоряет реакцию. Отрицательный катализ: катализатор замедляет реакцию.
Для изменения скорости реакции требуется иногда ничтожное количество катализатора. Пример: для заметного изменения скорости окисления сернокислого натрия в водном растворе достаточно 10-13 моль-экв катализатора (сернокислой меди) на литр раствора.
Понятием "катализ" объединяются явления, иногда сильно различающиеся по механизму действия катализаторов. Так, в цепных реакциях положительные катализаторы могут заметно облегчать возникновение цепей, (например, действие паров металлического натрия на смесь хлора с водородом). В других реакциях катализатор образует с реагирующими веществами промежуточные соединения, так называемый активный комплекс, -с меньшей энергией активации.
Различные катализаторы могут образовывать с одними и теми жевеществами как однотипно, так и различно построенные активные комплексы. В последнем случае, разница в конфигурациях активного комплекса может привести, к изменению направления процесса, и из одних и тех же исходных веществ могут образоваться различные продукты. Свойство катализаторов изменять направление процесса называется селективностью.
Химическое состояние катализатора после реакции и его количество не изменяются. Физическое же состояние может существенно измениться. Крупнокристаллическая двуокись МnO2 , катализирующая распад бертолетовой соли, после реакции превращается в мелкий, кристаллический порошок. Известно, что после длительного контактирования существенно изменяетсясостояние поверхностных слоев твердого катализатора.
Катализатор лишь ускоряет (или замедляет) процесс, но не способен смещать положение равновесия. Катализатор не может вызвать термодинамически невозможный процесс, так как катализатор входит лишь в состав промежуточного соединения, а термодинамическая возможность процесса определяется разностью уровней свободной энергии конечного и начального состояний. Химический процесс и в присутствии катализатора идет в направлении минимума свободной энергии в системе, только с большой скоростью. Катализатор снижает энергию активации процесса.
К гомогенно-каталитическим реакциям в жидкой фазе относятся ускоряющиеся под действием водородных ионов реакции этерификации и гидролиза сложных эфиров, инверсии сахаров, полимеризации олефинов в жидкой фазе и др. Роль катализатора сводится к снижению энергии активации процесса и, следовательно, к ускорению процесс. Пусть, например, бимолекулярная реакция в отсутствие катализатора протекает по схеме:
A+B→AB* (активированный комплекс)→продукты
В присутствии катализатора К, который принимает участие в образовании активного комплекса: А + В + К → АВК*→К + продукты, Е1-Е2= ∆Е - снижение энергии активации Е в присутствии катализатора (рис.1).
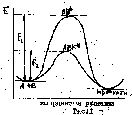
Основные положения гомогенного катализа (по Шпитальскому, 1926 г .):
1. Катализатор является таким веществом, которое переводит реагирующее вещество реакционно-способное состояние, представляющее собой неустойчивый активный комплекс.
2.Образование промежуточного соединения является обратим и относительно быстрым процессом.
3. Неустойчивый активный комплекс относительно медленно распадается с образованием продуктов реакции и с регенерацией катализатора.
4. Общая скорость процесса пропорциональна концентрации активного комплекса.
Гетерогенный катализ
Два типа гетерогенного катализа: катализатор находится в твердой фазе, а реагирующие вещества:1) в газовой, 2) в жидкости. Реакция, как правило, происходит на границе раздела фаз, т.е. на поверхности катализатора.
Гетерогенный процесс можно разделить, на три стадии:
I)транспорт реагирующих веществ к поверхности катализатора (диффузия);
2) реакция на поверхности катализатора;
3) десорбция продуктов реакции с освобождением поверхности катализатора.
Для сравнительной оценки активности катализаторов определяющей является скорость реакции на поверхности. Поэтому, в тех случаях, когда важно получить сравнение активностей катализатора, стараются процесс вести таким образом, чтобы скорость его определялась второй, так называемой кинетической стадией.
Характерные черты гетерогенных каталитических процессов.
Сродство реагирующих веществ к катализатору. Это положение подтверждается на опыте. Например, гидрогенизационные и дегидрогенизационные катализаторы Pt, Ni, Cu. легко образуют с водородом поверхностные соединения хемосорбционного типа: Pt-H, Ni-H, Cu-H. Гидратирующие и дегидратирующие катализаторы, например, А12O3 или Al2(SO4)3, обладают способностью образовывать с водой соединения гидратного типа, их действие в реакции дегидратации спиртов аналогично действию серной кислоты (типичного водоотнимающего средства). Окислительные катализаторы - Pt, Cu, Pd образуют с кислородом сорбционные поверхностные соединения типа. Cu легко восстанавливается до металлической меди и до СuО. Таким образом, сродство катализатора к реагирующим веществам обеспечивает образование промежуточного соединения, которое часто имеет неустойчивый характер и легко распадается на конечные продукты с регенерацией катализатора.
2) Избирательное действие катализатора, т.е. для одних и тех же исходных веществ различные катализаторы способны вызывать разные процессы, - приводящие к образованию различных конечных продуктов
С2Н5ОН С2Н4 + Н20
С2Н5ОН СН3СHO + H2
2С2Н5ОН CH2=CH-CH=CH2 + H2 + 2H2O
2С2Н5ОН C4H9OH + H2O
бутиловый спирт
Смешанные катализаторы. Для придания большей избирательности, повышения активности, термической стойкости, механической прочности применяют катализаторы в виде сложных многокомпонентных систем. Их три типа: смешанные, на носителях и промотированные. Смешанные катализаторы, как правило, смесь нескольких оксидов: Al2O3 + ThO2, Al2O3 +Cr2O3, CoO + MgO. Активность их часто является функцией состава.
4) Отравление катализатора. Присутствие, в реагирующей смеси некоторых веществ, часто в ничтожном количестве, способно поймать или полностью подавлять активность катализаторов. Такие вещества, называются каталитическими ядами. Типичными каталитическими ядами некоторых катализаторов гидрирования (Ni, РЬ)являются соединения серы (H2S, CS2, меркаптаны и т.д.), HCN, CO, галогены, Hgи ее соли, соединения Pb, Ag, Sb в количествах (моль/л): HCN (1/107), НgС12 (1/(2·106), Аs2O3 (1/50). Отравление катализатора в большинстве случаев происходит в результате адсорбции яда на поверхности. Различают обратимое отравление и необратимое отравление (соответственно обратимой и необратимой адсорбции). Поэтому катализаторы тщательно предохраняют от отравления и предъявляют специальные требования к аппаратуре: и очистке исходных веществ.
5) Промотирование катализатора. Активность катализатора часто увеличивается при добавлении к нему вещества, не обладающего каталитическими свойствами. Такие вещества называются промоторами. Например, катализатором реакции
СО + 3Н2→ СН4 + Н2О является никель. В отсутствие промоторов на одном чистом катализаторе мера скорости реакции 35 единиц:
Ni + 1% Cr2O3 – мера скорости реакции 300 ед.
Ni + 4% Cr2O3 - ”“ 620 ед.
Ni + 10% Cr2O3 - ”“ 600 ед.
Есть определённый предел добавки: просмотра, после которого его действие ослабляется и может даже привести к отравлению катализатора.
6. Активация в гетерогенных каталитических реакциях. Образующееся в ходе реакций промежуточное соединение адсорбируется на поверхностикатализатора. При этом происходит ослабление связей, способствующее их перераспределению и образованию конечных продуктов при меньшей суммарной затрате энергии. В большинстве случаев для константы скорости гетерогенной каталитической реакции справедливо уравнение Аррениуса: k = Z exp(-E/RT)
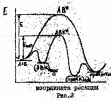
Сравним скорости некаталитической и каталитической реакций, для чего возьмем отношение констант скоростей этих реакций
Опыт показывает, что∆Е>О, в результате чего осуществляется ускорение каталитического процесса по сравнению с некаталитическим. Например:
А+В→АВ*→продукты ( в отсутствие катализатора). В присутствии катализатора процесс протекает через ряд стадий:
1) адсорбция на поверхности катализатора А + В + К →АВКадс
2) перевод адсорбционного состояния в активный комплекс АВКадс→ АВК*
3) АВК*→ (продукты)адсК
4) (продукты )адсК→ К + продукты
