
- •Минобрнауки россии
- •1. Литературная часть
- •1.1Колориметрические методы
- •1.1.1 Буферный метод
- •1.1.2 Безбуферный метод
- •1.1.3 Недостатки колориметрических методов.
- •1.2 Потенциометрические методы.
- •1.2.1 Нормальный элемент Вестона
- •1.2.2 Электроды сравнения
- •1.2.2.1 Водородный электрод
- •1.2.2.2 Каломельный электрод
- •1.2.2.3 Хлореребрянный электрод
- •1.2.2.4 Индикаторные электроды
- •1.2.3 Преимущества и недостатки различных потенциометрических методов определения pH
- •2. Экспериментальная часть
- •2.2 Методика определения pH буферных раствор.
- •3. Обсуждение результатов
- •3.2 Определение pH c использованием двойной хингидронной цепи.
- •3.3 Определение pH при помощи стеклянного электрода.
1.2.2.2 Каломельный электрод
Наибольшее распространение получил каломельный электрод, обладающий устойчивым и отлично воспроизводимым потенциалом. ( рис. 6.). На дно электродного сосуда помещают немного ртути, затем слой пасты из каломели Hg2Cl2 и ртути, сверху находятся кристаллы KCl. В ртуть опущена платиновая проволока к верхней клемме.
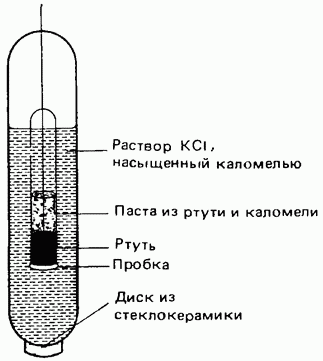
Рис.6. Каломельный электрод.
Каломель, растворяясь в небольшом объеме в воде, диссоциирует:
Hg2+2+2Cl−⇄Hg2Cl2
В присутствии хлористого калия, содержащего одноименный с каломелью ион хлора, растворимость каломели снижается еще больше. Так в растворе, насыщенном по отношению к каломели и содержащим определенное количество хлористого калия, находится строго постоянное при данной температуре количество ионов Hg2+2. Между металлической ртутью и, содержащим ее ионы, раствором возникает потенциал, который ввиду малой способности ртути переходить в раствор, имеет положительный знак по отношению к потенциалу нормального водородного электрода. Потенциал каломельного электрода. Потенциал каломельного электрода зависит от концентрации хлористого калия в растворе, влияющие на растворимость каломели и, следовательно, на концентрацию ионов Hg22+ в растворе [3].
1.2.2.3 Хлореребрянный электрод
Помимо каломельного электрода, на практике в качестве электрода сравнения используется хлорсеребряный электрод.
Серебрянный электрод, погруженный в раствор хлорида калия, насыщенный хлоридом серебра, образует систему:
||Hg2Cl2(нас.), KCl(X,M)|Ag,
и в нем протекает соответствующая полуреакция:
![]()
Обычно хлорсеребряный электрод изготавливают, используя насыщенный раствор хлорида калия; его потенциал при 25 оС равен +0,197 В, потенциал хлорсеребряного электрода в 1н растворе KCl равен +0,238 В, в 0,1н растворе KCl равен +0,290 в относительно стандартного водородного электрода.
Простой и несложный в изготовлении хлорсеребряный электрод показан на рис.7. Электрод помещают в трубку из пирекса, конец которой закрыт диском из спичечного стекла. Для предотвращения потери раствора из полуэлимента поверх диска помещают слой геля из агар-агара, насыщенного хлоридом калия. На гель помещают слой твердого хлорида калия и трубку заполняют насыщенным раствором соли. Добавляют одну-две капли 1 М раствора нитрата серебра и в раствор погружают толстую измерительную серебром проволочку [2]. Потенциал хлоресербрянного электрода зависит от концентрации (активности) ионов хлора в растворе и выражается уравнением:
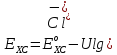 (17)
(17)
Где Ехс – потенциал хлорсеребряного электрода; Ехсо – нормальный потенциал хлорсеребряного электрода.
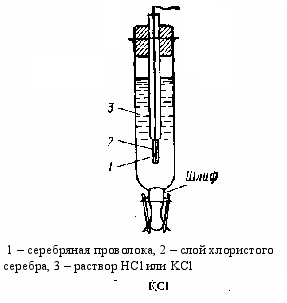
Рис.7. Хлорсеребряный электрод.
Потенциал этого электрода возникает на границе раздела Ag|Ag+.
Ввиду чрезвычайно малой растворимости AgСl, потенциал хлорсеребряного электрода имеет положительный знак по отношению к нормальному водородному электроду[2].
По сравнению с каломельным электродом, хлорсеребряный электрод имеет значительно меньший температурный коэффициент, т.е. его потенциал в меньшей степени изменяется с температурой и поэтому хлорсеребряный электрод находит более широкое применение в лабораторной практике. В отличии от каломельного, хлорсеребряный электрод не связан со ртутью, что делает его безопасным в работе.
