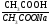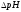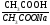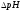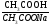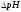- •Минобрнауки россии
- •1. Литературная часть
- •1.1Колориметрические методы
- •1.1.1 Буферный метод
- •1.1.2 Безбуферный метод
- •1.1.3 Недостатки колориметрических методов.
- •1.2 Потенциометрические методы.
- •1.2.1 Нормальный элемент Вестона
- •1.2.2 Электроды сравнения
- •1.2.2.1 Водородный электрод
- •1.2.2.2 Каломельный электрод
- •1.2.2.3 Хлореребрянный электрод
- •1.2.2.4 Индикаторные электроды
- •1.2.3 Преимущества и недостатки различных потенциометрических методов определения pH
- •2. Экспериментальная часть
- •2.2 Методика определения pH буферных раствор.
- •3. Обсуждение результатов
- •3.2 Определение pH c использованием двойной хингидронной цепи.
- •3.3 Определение pH при помощи стеклянного электрода.
3. Обсуждение результатов
Результаты проводили при температуре 298 К.
Концентрация фосфатного буферного раствора:
Сэкв ( CH3COOH) = 0,1 моль/л
Сэкв (CH3COONa)= 0,1 моль/л
pK CH3COOH=4,76
Объем исследуемого раствора 30 мл
3.1 Измерение pH с использованием хингидронно-каломельной цепи.
Результаты измерения представлены в табл. 1
Таблица 1.
|
Отношение концентраций
|
Ацетатный буферный р-р | ||
|
E, В |
pH | ||
|
найд. |
табл. | ||
|
9:1 |
0,231 |
3,79 |
3,72 |
|
8:2 |
0,213 |
4,10 |
4,05 |
|
7:3 |
0,199 |
4,33 |
4,27 |
|
6:4 |
0,188 |
4,52 |
4,45 |
|
5:5 |
0,176 |
4,72 |
4,63 |
|
4:6 |
0,166 |
4,89 |
4,80 |
|
3:7 |
0,157 |
5,05 |
4,99 |
|
2:8 |
0,141 |
5,31 |
5,23 |
|
1:9 |
0,118 |
5,70 |
5,57 |
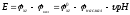
При
298 К
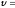 0,0591,
0,0591,
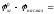 0,4552
В, тогда
0,4552
В, тогда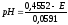
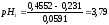
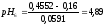
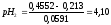
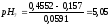
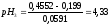
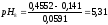
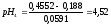
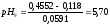
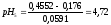
Определяем
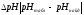 и
занесли в табл.2
и
занесли в табл.2
Табл.2
|
|
|
0,07 |
|
0,05 |
|
0,06 |
|
0,07 |
|
0,09 |
|
0,09 |
|
0,06 |
|
0,08 |
|
0,13 |
3.2 Определение pH c использованием двойной хингидронной цепи.
Результаты измерения представлены в табл. 3
Таблица 3.
|
Отношение концентраций
|
Ацетатный буферный р-р | ||
|
E, В |
pH | ||
|
найд. |
табл. | ||
|
9:1 |
0,106 |
3,84 |
3,72 |
|
8:2 |
0,119 |
4,05 |
4,05 |
|
7:3 |
0,137 |
4,36 |
4,27 |
|
6:4 |
0,148 |
4,54 |
4,45 |
|
5:5 |
0,159 |
4,73 |
4,63 |
|
4:6 |
0,169 |
4,90 |
4,80 |
|
3:7 |
0,180 |
5,08 |
4,99 |
|
2:8 |
0,192 |
5,25 |
5,23 |
|
1:9 |
0,213 |
5,65 |
5,57 |

При
298 К
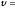 0,0591, тогда
0,0591, тогда
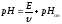 или
или
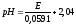
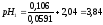
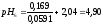
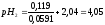
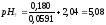
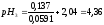
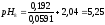
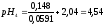
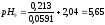

Определяем
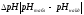 и
занесли в табл. 4
и
занесли в табл. 4
Табл. 4
|
|
|
0,12 |
|
0,00 |
|
0,09 |
|
0,09 |
|
0,10 |
|
0,10 |
|
0,09 |
|
0,06 |
|
0,08 |
3.3 Определение pH при помощи стеклянного электрода.
Результаты измерения представлены в табл. 5
Таблица 5
|
Отношение концентраций
|
Ацетатный буферный р-р | ||
|
pH | |||
|
опыт. |
рассч. |
табл. | |
|
9:1 |
3,80 |
3,81 |
3,72 |
|
8:2 |
4,07 |
4,16 |
4,05 |
|
7:3 |
4,31 |
4,39 |
4,27 |
|
6:4 |
4,49 |
4,58 |
4,45 |
|
5:5 |
4,70 |
4,76 |
4,63 |
|
4:6 |
4,85 |
4,94 |
4,80 |
|
3:7 |
5,00 |
5,13 |
4,99 |
|
2:8 |
5,27 |
5,36 |
5,23 |
|
1:9 |
5,62 |
5,69 |
5,57 |
Вычисляем
pHрассч
по формуле:
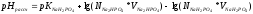
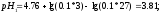
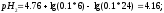

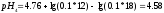
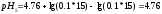
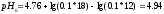
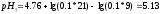
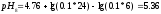
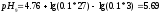
Определяем
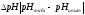 и
занесли в табл. 6
и
занесли в табл. 6
Табл. 6
|
|
|
0,08 |
|
0,02 |
|
0,04 |
|
0,04 |
|
0,07 |
|
0,05 |
|
0,01 |
|
0,04 |
|
0,05 |
Выводы
Составили краткий литературный обзор по методам определения pH растворов. Рассмотрели колориметрические и потенциометрические методы, различные виды электродов.
Освоили методики потенциометрического определения pH буферных растворов с помощью различных электрохимических цепей, таких как: хингидронно-каломельная, двойная хингидронная цепь и цепь составленная из стеклянная из стеклянного и хлорсеребряного электродов.
Освоили методику работы на высокообменом потенциометре постоянного тока
Наиболее точные результаты получаются при работе на pH-метре с использованием стеклянного и хлорсеребряного электродов. Эта электрохимическая цепь является наиболее предпочтительной при измерении pH растворов.
Литература
[1] Болдырев А.И. Физическая и коллоидная химия – М.: В.Ш. , 1974
[2] Курс физической химии, m.II, под ред. чл.-корр. АН СССР проф. Я.И. Герасимова. Издание 2, испр., М., «Химия», 1973
[3] Электрохимия. Метод указанный в лабораторных практикумах/ чув. универ-та; Андреева Э.В., Кольцов Н.И., Чебоксары
[4] Лурье Ю.Ю. Справочник по аналитической химии. 5-е изд.
[5] – [6 ] [https://ru.wikipedia.org/wiki