
- •Хакасский государственный университет
- •Глава I. Поверхностные явления и адсорбция.
- •Работа 2. Адсорбция на поверхности раздела раствор-воздух
- •Объем раствора; мл
- •Навеска угля; г
- •Находят значения Сi / г и строят график зависимости
- •Вопросы и задания для самоконтроля
- •Глава II. Получение коллоидных систем и изучение их физико-химических свойств
- •Работа 4. Получение золей методами конденсации и пептизации
- •Эмульсии
- •Работа 7. Седиментационный анализ суспензий
- •Порядок выполнения работы:
- •Вопросы и задания для самоконтроля
- •Глава III. Устойчивость и коагуляция коллоидных систем
- •Цель работы: Определение порога коагуляции золя гидроксида железа оптическим методом.
- •1. Определение порога коагуляции золя Fe(oh)3
- •2. Определение порога коагуляции золя берлинской лазури
- •Вопросы и задания для самоконтроля
- •Глава IV. Коллоидные поверхностно-активные вещества
- •Работа 12. Определение солюбилизирующей способности пав
- •Глава V. Свойства высокомолекулярных соединений и их растворов
- •Библиографический список
- •Приложение № 1 порядок оформления лабораторных работ
Работа 2. Адсорбция на поверхности раздела раствор-воздух
Цель работы: Установление зависимости поверхностного натяжения на границе раствор-воздух от концентрации раствора поверхностно-активного вещества. Построение изотермы адсорбции. Определение основных характеристик поверхностного слоя.
Количественная зависимость между величиной адсорбции и изменением поверхностного натяжения σ описывается уравнением Гиббса. Для разбавленных растворов оно имеет вид:
![]() (8)
(8)
где С – концентрация раствора, моль/л;
R – универсальная газовая постоянная (8.31·107эрг/моль·К);
Т – абсолютная температура;
![]() - поверхностная активность.
- поверхностная активность.
Из уравнения следует, что вещества,
повышающие поверхностное натяжение (![]() > 0), показывают отрицательную адсорбцию
(Г < 0). Это поверхностно-инактивные
вещества. Вещества, понижающие
поверхностное натяжение (
> 0), показывают отрицательную адсорбцию
(Г < 0). Это поверхностно-инактивные
вещества. Вещества, понижающие
поверхностное натяжение (![]() < 0), показывают положительную адсорбцию
(Г > 0). Это поверхностно-активные
вещества. Величина -
< 0), показывают положительную адсорбцию
(Г > 0). Это поверхностно-активные
вещества. Величина -![]() является мерой способности вещества
понижать поверхностное натяжение
(поверхностную энергию); она называется
поверхностной активностью, обозначаетсяG. Размерность ее
является мерой способности вещества
понижать поверхностное натяжение
(поверхностную энергию); она называется
поверхностной активностью, обозначаетсяG. Размерность ее![]() или
или![]() .
Поверхностную активность определяют
по изотерме поверхностного натяжения,
т.е. по кривой зависимости
.
Поверхностную активность определяют
по изотерме поверхностного натяжения,
т.е. по кривой зависимости![]() ,
полученной экспериментально. Пользуясь
уравнением Гиббса, можно найти значение
адсорбции при различных концентрациях
и определить характеристики поверхностного
слоя, а именно: максимальное значение
адсорбции, площадь, занимаемую молекулой
в предельно насыщенном слое, толщину
адсорбционного слоя (длину молекулы).
,
полученной экспериментально. Пользуясь
уравнением Гиббса, можно найти значение
адсорбции при различных концентрациях
и определить характеристики поверхностного
слоя, а именно: максимальное значение
адсорбции, площадь, занимаемую молекулой
в предельно насыщенном слое, толщину
адсорбционного слоя (длину молекулы).
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ:
В мерной колбе на 100 мл готовят 0.25 н раствор исследуемого поверхностно-активного вещества. Для этого рассчитывают объём исходного раствора вещества (мл), необходимый для приготовления раствора данной концентрации. Рассчитанный объём отмеряют пипеткой в мерную колбу на 100 мл и доводят дистиллированной водой до метки.
Отбирают половину приготовленного раствора в мерную колбу вместимостью 50 мл и переливают в обычную колбу с пробкой. К оставшемуся в 100 мл колбе раствору (0.25 н) приливают дистиллированную воду до метки, т.е. разбавляют раствор в 2 раза. Новый раствор имеет концентрацию 0.125 н. Таким же образом приготовляются растворы: 0.0625, 0.0312, 0.0156 и 0.0078 н, т.е. всего шесть растворов.
Измерение поверхностного натяжения производят сталагмометром. Для этого засасывают резиновой грушей в сталагмометр сначала дистиллированную воду так, чтобы она стояла выше верхней метки (кран бокового капилляра предварительно устанавливают так, чтобы при закрытом режиме вода медленно капала из сталагмометра не быстрее, чем одна капля за 2-3 секунды) и подсчитывают число капель воды, заключающихся в объеме между верхней и нижней метками сталагмометра. Необходимо следить, чтобы во время измерений сталагмометр был строго в вертикальном положении, а его нижний срез находился над поверхностью раствора на расстоянии 1-2 см. Засасывание и отсчет капель при каждом измерении повторяют 3-4 раза (допустимые расхождения между отдельными измерениями не должны превышать 1 капли). Берут среднее значение числа капель.
Споласкивают сталагмометр первым исследуемым раствором (0.0078 н), заполняют его этим раствором и снова определяют число капель N, заключающееся в том же объеме сталагмометра, как это было описано для воды.
Измерение поверхностного натяжения проводят последовательно для каждого приготовленного раствора отдельно. Измерения начинают с наиболее разбавленного раствора и идут к более концентрированным растворам. Получают значение числа капель N.
Расчет поверхностного натяжения производят по уравнению (7).
Измерив поверхностное натяжение всех растворов и произведя расчеты, получают данные, показывающие зависимость между поверхностным натяжением σ и концентрацией раствора с.
По полученным данным строят изотерму поверхностного натяжения, т.е. график зависимости
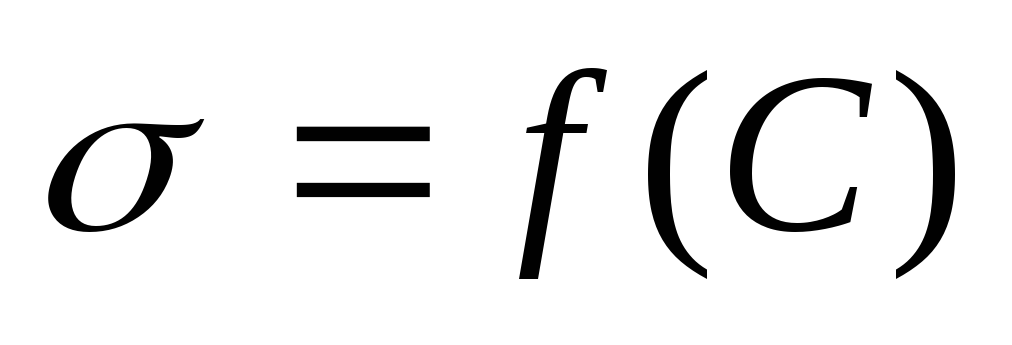 .
Предварительно следует составить
таблицу.1
.
Предварительно следует составить
таблицу.1
|
№ п/п |
C, моль/л |
N |
, дин/см |
№ п/п |
C, моль/л |
N |
, дин/см | |
|
0 |
0.0 (вода) |
|
|
4 |
0.0625 |
|
| |
|
1 |
0.0078 |
|
|
5 |
0.125 |
|
| |
|
2 |
0.0156 |
|
|
6 |
0.250 |
|
| |
|
3 |
0.0312 |
|
|
| ||||
9. Проводят графическую обработку
полученной изотермы поверхностного
натяжения. Для этого к кривой
![]() в нескольких точках строят касательные
до пересечения с осью ординат (приложение
2).
в нескольких точках строят касательные
до пересечения с осью ординат (приложение
2).
Ч ерез
точки, в которых построены касательные,
проводят прямые, параллельные оси
абсцисс, до пересечения с осью ординат.
Отрезок Z (Рис. 3), выраженный в единицах
поверхностного натяжения:
ерез
точки, в которых построены касательные,
проводят прямые, параллельные оси
абсцисс, до пересечения с осью ординат.
Отрезок Z (Рис. 3), выраженный в единицах
поверхностного натяжения:
![]() т.к. согласно построению
т.к. согласно построению![]()
Из найденного отношения и уравнения (8) следует:
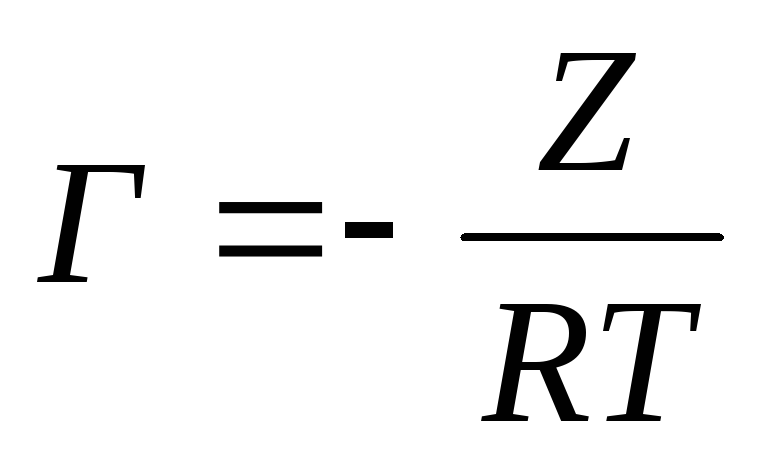 .
Вычислив значение Г для нескольких (не
менее шести) концентраций, строят график
зависимости
.
Вычислив значение Г для нескольких (не
менее шести) концентраций, строят график
зависимости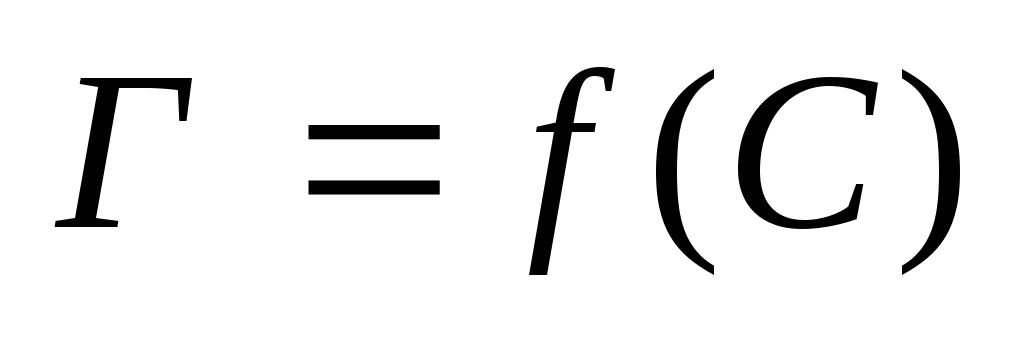 (рис.
3).
(рис.
3).Для вычисления предельной адсорбции
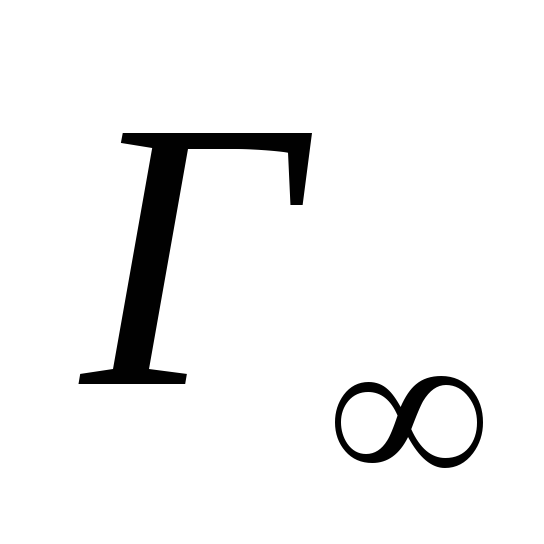 пользуются уравнением Лэнгмюра:
пользуются уравнением Лэнгмюра:
![]() ,
(9)
,
(9)
где К – коэффициент, характеризующий сродство адсорбента к адсорбтиву.
Преобразовав уравнение (5), получают:
![]()
Е сли
принять
сли
принять![]() ,
,![]() ,
то
,
то![]() ,
т.е. получается уравнение прямой, у
которойa=tgγ(рис 4). Вычисляют
,
т.е. получается уравнение прямой, у
которойa=tgγ(рис 4). Вычисляют![]() и строят график, откладывая на оси
абсцисс С, а на оси ординат
и строят график, откладывая на оси
абсцисс С, а на оси ординат![]() .
Через полученные экспериментальные
точки проводят прямую. Котангенс угла
наклона этой прямой равен
.
Через полученные экспериментальные
точки проводят прямую. Котангенс угла
наклона этой прямой равен![]() .
Для нахождения котангенса строят
прямоугольный треугольник АВD,
принимая прямую
.
Для нахождения котангенса строят
прямоугольный треугольник АВD,
принимая прямую![]() за гипотенузу (рис. 4). Катет АВ выражен
в единицах концентрации С, катет ВDвыражен в единицах
за гипотенузу (рис. 4). Катет АВ выражен
в единицах концентрации С, катет ВDвыражен в единицах![]() .
Тогда
.
Тогда
![]()
Так как
 -
число моль вещества, адсорбированного
на 1 см2поверхности, Г∞∙NА– число молекул, адсорбированных на
этой площади. NА- число Авогадро
(NА= 6.023·1023). Площадьs,
приходящаяся на одну молекулу
адсорбированного вещества, т.е. площадь,
занимаемая его полярной группой на
поверхности раздела раствор-воздух
-
число моль вещества, адсорбированного
на 1 см2поверхности, Г∞∙NА– число молекул, адсорбированных на
этой площади. NА- число Авогадро
(NА= 6.023·1023). Площадьs,
приходящаяся на одну молекулу
адсорбированного вещества, т.е. площадь,
занимаемая его полярной группой на
поверхности раздела раствор-воздух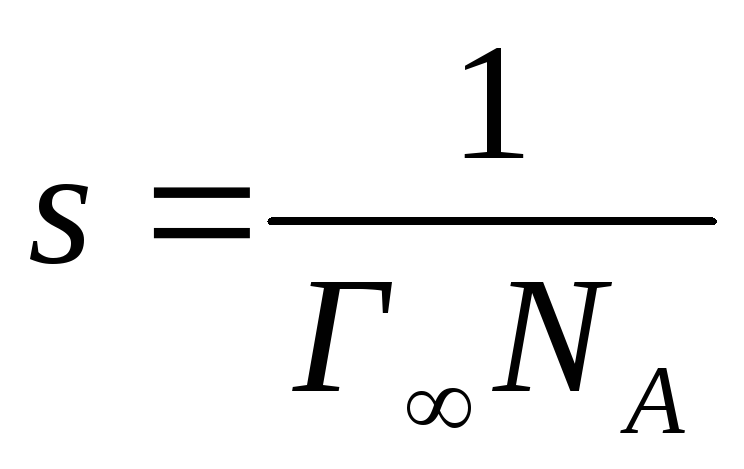 см2. Чтобы выразитьsв Å2, следует умножить полученный
результат на 11016.
см2. Чтобы выразитьsв Å2, следует умножить полученный
результат на 11016.Если обозначить m – массу одной молекулы адсорбированного вещества, то
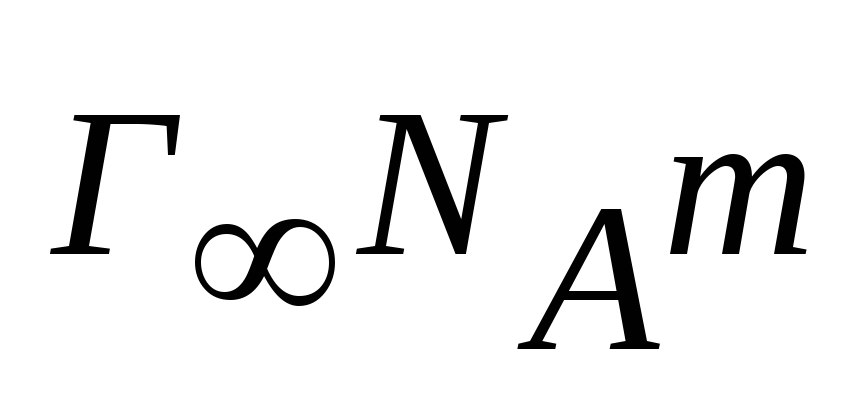 - масса молекул, адсорбированных на 1
см2поверхности. Если ρ – плотность
спирта, то
- масса молекул, адсорбированных на 1
см2поверхности. Если ρ – плотность
спирта, то
![]() .
.
где![]() - объем молекул, адсорбированных на 1
см2поверхности.
- объем молекул, адсорбированных на 1
см2поверхности.
С другой стороны, объем
![]() = 1см2
= 1см2 ![]() ,
где
,
где![]() - толщина адсорбированного слоя, или,
если предположить, что этот слой
мономолекулярный, то
- толщина адсорбированного слоя, или,
если предположить, что этот слой
мономолекулярный, то![]() - длина молекулы. Следовательно:
- длина молекулы. Следовательно:
![]() см, или, так как М=m∙NА,
см, или, так как М=m∙NА,
![]() .
.
где М – молярная масса адсорбированного вещества.
По этому уравнению и вычисляют
![]() - длину молекулы. Результаты математической
обработки и полученных данных удобно
представить в таблице.
- длину молекулы. Результаты математической
обработки и полученных данных удобно
представить в таблице.
|
С |
Z |
Г·10-10 |
С/Г · 108 |
Г 10-10 |
s,Å 2 |
Δ, Å |
|
0.125 |
|
|
|
|
|
|
|
0.025 |
|
|
|
|
|
|
|
0.050 |
|
|
|
|
|
|
|
0.10 |
|
|
|
|
|
|
|
0.15 |
|
|
|
|
|
|
|
0.20 |
|
|
|
|
|
|
Работа 3. ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ПОВЕРХНОСТИ АДСОРБЕНТА
Цель работы: Определение удельной поверхности активированного угля.
Удельной поверхностью Sудадсорбента называется поверхность 1 г адсорбента. Удельная поверхность – важная характеристика адсорбентов, так как она определяет их пористость и способность адсорбировать. Существует много способов определения Sуд. В рассматриваемом ниже адсорбционном способе находят две величины: максимальную адсорбцию (предельную адсорбцию) Гповерхностно-активного вещества на 1 см2 поверхности адсорбент-раствор и максимальную адсорбцию Гэтого же вещества 1 г адсорбента.
Значение Гнаходят по изотерме поверхностного натяжения растворов поверхностно-активного вещества (ПАВ). Ввиду того, что при максимальной адсорбции молекулы адсорбтива образуют монослой с плотной упаковкой (частокол Лэнгмюра), число моль, адсорбированных 1 см2поверхности, т.е. Гопределяется только площадью молекулы и не зависит от природы поверхности. Поэтому значение максимальной адсорбции, найденное на границе раствор – воздух, может быть использовано и в случае границы раствор – адсорбент, т.е. для определения удельной поверхности адсорбента.
Для определения Грастворы ПАВ приводят в соприкосновение с адсорбентом - активированным углем. При этом происходит адсорбция ПАВ на угле, уменьшается концентрация раствора и увеличивается его поверхностное натяжение. По значению поверхностного натяжения раствора после адсорбции можно установить концентрацию в нем ПАВ. Значение адсорбции 1 г угля находят по разности концентраций адсорбтива в растворе до и после адсорбции. Наибольшее значение этой величины Гопределяют по изотерме адсорбции. По уравнению
![]() (10)
(10)
находят удельную поверхность адсорбента.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ:
Готовят по 50 мл растворов исследуемого спирта с концентрациями 0.25; 0.125; 0.0625; 0.0312; 0.0156; 0.0078 моль/л и определяют их поверхностное натяжение σ '.
Берут 6 навесок по 2.5 г активированного угля и вносят их одновременно в растворы спирта.
После 45 минутного выдерживания уголь отфильтровывают одновременно через бумажные фильтры.
Определяют поверхностное натяжение фильтратов сталагмометрическим методом по воде, т. е. подсчитывают число капель воды и фильтратов в равных объемах.
Вычисляют поверхностное натяжение фильтратов и по графику = f (С) находят их концентрации Сi в моль/л.
Все данные сводят в таблицу:
