
- •Хакасский государственный университет
- •Глава I. Поверхностные явления и адсорбция.
- •Работа 2. Адсорбция на поверхности раздела раствор-воздух
- •Объем раствора; мл
- •Навеска угля; г
- •Находят значения Сi / г и строят график зависимости
- •Вопросы и задания для самоконтроля
- •Глава II. Получение коллоидных систем и изучение их физико-химических свойств
- •Работа 4. Получение золей методами конденсации и пептизации
- •Эмульсии
- •Работа 7. Седиментационный анализ суспензий
- •Порядок выполнения работы:
- •Вопросы и задания для самоконтроля
- •Глава III. Устойчивость и коагуляция коллоидных систем
- •Цель работы: Определение порога коагуляции золя гидроксида железа оптическим методом.
- •1. Определение порога коагуляции золя Fe(oh)3
- •2. Определение порога коагуляции золя берлинской лазури
- •Вопросы и задания для самоконтроля
- •Глава IV. Коллоидные поверхностно-активные вещества
- •Работа 12. Определение солюбилизирующей способности пав
- •Глава V. Свойства высокомолекулярных соединений и их растворов
- •Библиографический список
- •Приложение № 1 порядок оформления лабораторных работ
Глава V. Свойства высокомолекулярных соединений и их растворов
Высокомолекулярные соединения (ВМС) — как природные, составляющие основу всей живой материи, так и синтетические, — вещества, образованные из цепных макромолекул с молекулярным весом от нескольких тысяч до нескольких миллионов. Они построены из небольших групп (звеньев) атомов, соединенных химическими связями. Разнообразие физических свойств аморфных и кристаллических ВМС определяется химическим составом макромолекул (от него зависит способ их укладки для образования конечных структур) и температурой. Макромолекулы образуют цепи разнообразных геометрических форм.
ВМС набухают и растворяются в низкомолекулярных жидкостях. Так как подвижность молекулы растворителя намного больше подвижности макромолекул, то первой стадией взаимодействия является набухание которое сводится к проникновению молекул растворителя вглубь ВМС со значительным увеличением его массы и объема, но с сохранением формы; образуется гель. Если низкомолекулярная жидкость ограниченно растворима в ВМС, то набухание будет ограниченным, оно не заканчивается образованием текучей системы. Растянутая сетка макромолекул, стремясь сократиться, препятствует увеличению содержания растворителя. При неограниченной растворимости низкомолекулярной жидкости в полимере его пачки после набухания продолжают раздвигаться, и макромолекулы постепенно диффундируют в растворитель, образуя раствор. Такое набухание называют неограниченным. Основным отличием разбавленных равновесных растворов ВМС от лиофобных золей является их термодинамическая устойчивость, что свойственно и истинным растворам. Набухание характеризуется степенью набухания , под которой понимают количество жидкости в граммах, поглощенной к данному моменту времени при данной температуре одним граммом полимера.
Если звенья макромолекулы содержат боковые ионогенные группы, то полимеры проявляют своеобразные электрические, конфигурационные и гидродинамические свойства. Такие полимеры называют полиэлектролитами. К ним относятся поликислоты, полиоснования, полиамфолиты. Полиамфолиты содержат кислотные и основные группы в одной макромолекуле. Это белки и синтетические полипептиды. Они построены из аминокислот и содержат основные (NH2-, OH-) и кислотные (COOH-) группы, которые располагаются не только на концах цепей, но и в боковых ответвлениях. Раствор каждого полиамфолита в зависимости от его состава имеет определенное значение pH, при котором сумма положительных и отрицательных зарядов в цепи равны. Это значение pH называется изоэлектрической точкой (ИЭТ). При pH ниже ИЭТ в цепи преобладают положительные заряды из-за подавления диссоциации COOH- групп. При достаточно низком значении pH, полиамфолит превращается в полиоснование. При pH выше ИЭТ полиамфолит постепенно переходит в поликислоту.
Конформация цепи определяется степенью ионизации – удаленностью pH от ИЭТ. В ИЭТ полиамфолит показывает минимальные степень набухания и растворимость, а его раствор – максимальную мутность и минимальную вязкость и электропроводность. Это позволяет использовать зависимость указанных свойств от pH раствора для определения ИЭТ амфолитов.
Молекулярный вес полимера, форму макромолекул и энергию их взаимодействия с растворителем определяют по свойствам растворов ВМС. Большинство полимеров обладают набором молекулярных весов, они полимолекулярны и для них пользуются понятием среднего молекулярного веса. Молекулярный вес определяют по светорассеянию, осмотическому давлению, вязкости и др.
Работа 13. ИССЛЕДОВАНИЕ НАБУХАНИЯ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ
Цель работы: Изучение процесса набухания ВМС. Исследование влияния pH и электролитов на набухание желатины, определение ИЭТ желатины, определение степени набухания желатины.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ:
1. Влияние pH среды на набухание желатины
определяют следующим образом
В 6 пронумерованных стаканчиков наливают по 20 мл ацетатной буферной смеси, состав которой указан в таблице.
Измеряют на pH-метре pH всех растворов. Данные заносят в таблицу.
Взвешивают на аналитических весах 6 пластинок желатины. Помещают по одной пластинке в каждый стаканчик. Данные заносят в таблицу.
Через 30-40 минут пластинки желатины вынимают, подсушивают на фильтровальной бумаге и вновь взвешивают. Данные заносят в таблицу.
|
№ |
Состав буферной смеси |
pH |
Масса желатины, г |
,% | ||
|
CH3COONa 0.1М, мл |
CH3COOH 0.1М, мл |
До набухания, m0 |
После набухания, m | |||
|
1 |
1.5 |
18.5 |
|
|
|
|
|
2 |
3.6 |
16.4 |
|
|
|
|
|
3 |
7.4 |
12.6 |
|
|
|
|
|
4 |
11.8 |
8.2 |
|
|
|
|
|
5 |
17.6 |
2.4 |
|
|
|
|
|
6 |
18.8 |
1.2 |
|
|
|
|
Степень набухания вычисляют по формуле:
![]()
где m – масса набухшей желатины, m0– масса сухой желатины.
Строят график зависимости =f(pH)
По графику определяют изоэлектрическую точку (ИЭТ) желатины
2. Влияние кислоты, щелочи и солей на набухание
определяют следующим образом:
В 7 калиброванных пробирок вносят одинаковое количество желатины по высоте пробирки (примерно 1 мл).
В каждую пробирку наливают по 5 мл указанных в таблице растворов.
Содержимое пробирок перемешивают стеклянной палочкой, чтобы частицы желатины опустились на дно. Определяют высоту осадка желатины до набухания.
Пробирки оставляют в штативе на 30 минут.
По истечении этого времени каждую пробирку еще раз встряхивают, дают осадку осесть и измеряют высоту набухшего осадка желатины. Данные заносят в таблицу.
|
№ |
Раствор |
Высота осадка, мл | |
|
До набухания |
После набухания | ||
|
1 |
Вода |
|
|
|
4 |
0.1М NaCl |
|
|
|
5 |
0.1М KCl |
|
|
|
6 |
0.1М K2SO4 |
|
|
|
7 |
0.1М KCNS |
|
|
На основании полученных данных делают вывод:
о влиянии кислоты, щелочи и солей на процесс набухания
о влиянии природы анионов на процесс набухания.
Работа 14. ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОГО ВЕСА ПОЛИМЕРОВ
Цель работы: Определение молекулярного веса желатины методом вискозиметрии.
Установлено, что характеристическая вязкость [η] связана с молекулярным весом растворенного полимера, следующим образом:
![]() (1)
(1)
где К– константа, отражающая особенности химического строения макромолекул,
- константа, зависящая от строения полимера и его взаимодействия с растворителем,
[] находится из
графика зависимости![]() ,
,
![]() (приведенная
вязкость) в свою очередь рассчитывается
по формуле:
(приведенная
вязкость) в свою очередь рассчитывается
по формуле:
![]() ,
,
![]() (удельная
вязкость) находится из опыта, путем
измерения времени истечения жидкости
(раствора):
(удельная
вязкость) находится из опыта, путем
измерения времени истечения жидкости
(раствора):
![]()
t – время истечения раствора,
t0- время истечения растворителя.
Для расчета молекулярного веся полимера M формула (1) преобразуется следующим образом:
![]() ;
;![]() ;
;
откуда
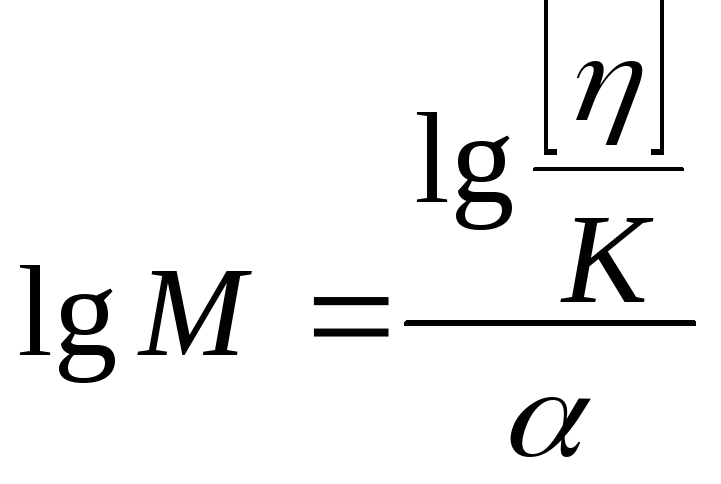 (2)
(2)
Характеристическая вязкость здесь используется потому, что она не связана с концентрацией раствора, а зависит только от молекулярного веса растворенного полимера.
Определение молекулярного веса полимеров методом вискозиметрии можно проводить только в достаточно разбавленных растворах, когда имеет место подчинение законам Ньютона и Пуазейля, то есть когда исключена возможность образования структур и взаимодействие макромолекул.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ:
Определение времени истечения жидкости производят в капиллярном вискозиметре Оствальда (рис. 12), который представляет собой U – образную трубку с двумя шариками. От верхнего шарика отходит капилляр, переходящий затем в широкую трубку. Сверху и снизу верхнего шарика нанесены метки.
П рибор
промывают хромовой смесью, 2-3 раза
водопроводной, 3 раза – дистиллированной
водой и споласкивают раствором, вязкость
которого предстоит измерять. Затем в
правое колено вискозиметра при помощи
пипетки вводят строго определенное
количество испытуемой жидкости. Ее
объем выбирают таким образом, чтобы
после наполнения левого колена до
верхней метки нижний мениск находился
бы в нижней части нижнего шарика. Жидкость
засасывают при помощи резиновой груши
в левое колено вискозиметра настолько,
чтобы ее верхний мениск был на 2-3 мм выше
верхней метки. Затем дают жидкости
свободно течь через капилляр. Секундомером
измеряют время прохождения мениска от
верхней метки до нижней. Рекомендуются
вискозиметры с временем истечения воды
100-120 с. Измерения проводят при определенной
температуре, для чего вискозиметр
помещают в водяной термостат. В качестве
термостата может быть использован
большой химический стакан, наполненный
водой и снабженный мешалкой, электрическим
(или газовым) подогревом и термометром.
Прибор перед измерением выдерживают в
термостате 15-20 минут для того, чтобы
испытуемая жидкость приняла необходимую
температуру.
рибор
промывают хромовой смесью, 2-3 раза
водопроводной, 3 раза – дистиллированной
водой и споласкивают раствором, вязкость
которого предстоит измерять. Затем в
правое колено вискозиметра при помощи
пипетки вводят строго определенное
количество испытуемой жидкости. Ее
объем выбирают таким образом, чтобы
после наполнения левого колена до
верхней метки нижний мениск находился
бы в нижней части нижнего шарика. Жидкость
засасывают при помощи резиновой груши
в левое колено вискозиметра настолько,
чтобы ее верхний мениск был на 2-3 мм выше
верхней метки. Затем дают жидкости
свободно течь через капилляр. Секундомером
измеряют время прохождения мениска от
верхней метки до нижней. Рекомендуются
вискозиметры с временем истечения воды
100-120 с. Измерения проводят при определенной
температуре, для чего вискозиметр
помещают в водяной термостат. В качестве
термостата может быть использован
большой химический стакан, наполненный
водой и снабженный мешалкой, электрическим
(или газовым) подогревом и термометром.
Прибор перед измерением выдерживают в
термостате 15-20 минут для того, чтобы
испытуемая жидкость приняла необходимую
температуру.
Разбавлением в 1.5, 2, 4, 10 раз исходного 4∙10-4mраствора желатины готовят 4 раствора по 30 мл. Измеряют время истечения растворов, начиная с самого разбавленного. Каждое измерение проводят по 3 раза. Следят, чтобы при измерениях вискозиметр был закреплен строго вертикально.
Для каждого раствора рассчитывают
![]() и
и![]() .
Результаты измерений и вычислений
заносят в таблицу:
.
Результаты измерений и вычислений
заносят в таблицу:
|
С % |
t, |
t - t0 |
η уд |
η пр |
|
|
|
|
|
|
Находят
характеристическую вязкость, для чего
строят кривую
![]() =f(C)
и экстраполируют ее к С→0 (приложение
2). Используя найденную величину [η], по
уравнению (2) рассчитывают М.
=f(C)
и экстраполируют ее к С→0 (приложение
2). Используя найденную величину [η], по
уравнению (2) рассчитывают М.
Константы в уравнении (2) для желатины: К = 4,53∙10-5, α = 0,74.
ВОПРОСЫ И ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Каковы особенности растворения полимеров?
2. Почему растворы ВМС являются термодинамически устойчивыми?
3. В чем сходство и различие между растворами ВМС и коллоидными растворами?
4. Какой процесс называется набуханием? Каким оно бывает?
5. Что такое степень набухания и как она определяется?
6. Какие факторы влияют на степень набухания полимеров?
7. Что такое изоэлектрическая точка белка? Объясните связь между изоэлектрической точкой и степенью набухания.
8. Что такое вязкость? Каковы особенности вязкости растворов полимеров?
9. Можно ли измеряя вязкость растворов ВМС определить их изоэлектрическую точку? Ответ объясните.
10. Каким образом, зная вязкость раствора полимера определить его среднюю молекулярную массу?
11. Каково практическое применение растворов полимеров?
