
Травень В.Ф. - Органическая химия. В 3 т. Т. 2
..pdf
16.4. Реакции |
341 |
спирт или нагревая спирты с концентрированными растворами галогеноводородных кислот. Бромалканы часто получают нагреванием спиртов (кроме третичных) с бромидом натрия или калия и разбавленной серной кислотой.
CH3CH2OH |
KBr + H2SO4 |
CH3CH2Br |
|
–H2O, 60 °C |
|
||
этанол |
|
|
этилбромид |
HBr
 OH
OH 


 Br + H2O
Br + H2O
циклогексанол бромциклогексан
СH |
|
CH |
|
CH |
|
CH |
HI (конц.) |
СH |
|
CH |
|
CH |
|
CH |
+ H O |
||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
||||||||||||||||
3 |
|
2 |
3 |
3 |
|
2 |
3 |
2 |
|||||||||||
|
|
|
OH |
|
|
|
|
|
|
I |
|
|
|||||||
|
|
|
2-бутанол |
|
|
|
|
|
|
2-иодбутан |
|
|
|||||||
н-Бутилбромид. Смесь 48%-й HBr (71 мл), конц. H2SO4 (30,5 мл) и н-бутанола (37 г; 0,5 моль) кипятят в течение 2 ч. Продукт отделяют, промывают водой, сушат и перегоняют, т. кип. 101,6 °С. Выход 65 г (95%).
Реакционная способность галогеноводородов в реакциях со спиртами уменьшается в ряду:
HI > HBr > HCl
По механизму бимолекулярного нуклеофильного замещения (SN2) протекают реакции метанола и большинства пространственно незатрудненных первичных спиртов, в ходе которых карбокатионы образуются с трудом.
CH CH CH OH |
KBr + H2SO4 |
CH CH CH Br + H O |
|||
H2O, t |
|
||||
3 2 2 |
3 2 2 |
2 |
|||
1-пропанол |
|
|
1-бромпропан |
|
|
Реакции, как правило, не сопровождаются перегруппировками. Их механизм включает следующие стадии.
Стадия 1 — образование алкилгидроксониевого иона:
|
|
H |
|
|
|
H |
CH3CH2CH2OH |
|
|
CH3CH2CH2 |
|
O |
|
|
|
|
|
|||
быстро |
|
|||||
|
|
|
|
H |
||
|
|
|
|
|
|
|

16.4. Реакции |
|
|
|
|
|
|
|
|
|
|
|
343 |
||||||
Стадия 1 — образование алкилгидроксониевой соли: |
||||||||||||||||||
|
|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 |
|
|||||
|
|
|
|
HBr |
|
|
|
|
H |
|
||||||||
|
|
|
|
|
|
|||||||||||||
CH3 |
|
C |
|
OH |
|
CH3 |
|
C |
|
O |
H |
Br |
||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
CH3 |
|
|
|
|
|
|
CH3 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
Стадия 2 — диссоциация алкилгидроксониевого иона с отщеплением воды и образованием карбокатиона (эта стадия является скоростьлимитирующей):
CH3 |
|
|
|
CH3 |
H |
|
|
|
CH3 |
|
|
CH3 |
||
|
|
|
|
|
|
|||||||||
|
C |
|
O |
H |
|
|
|
|
C |
+ H2O. |
||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
CH3 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||||
Стадия 3 — присоединение бромид-иона к карбокатиону (протекает быстро):
|
|
CH3 |
|
Br |
|
CH3 |
||||||
|
|
|
||||||||||
CH3 |
|
C |
|
|
|
CH3 |
|
C |
|
Br |
||
|
|
|
|
|
|
|||||||
|
|
|
|
|||||||||
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|||||||
|
|
|
|
|
|
|
|
|||||
Последняя стадия осложняется побочной реакцией Е1 — отщеплением протона с образованием алкена:
|
|
CH3 |
|
Br |
|
CH3 |
||||||
|
|
|
||||||||||
CH3 |
|
C |
|
|
|
CH3 |
|
C |
|
CH2 + HBr |
||
|
|
|
|
|
|
|||||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|||||||
 CH2
CH2
H
Согласно кинетическому уравнению
w = k1[(CH3)3COH],
скорость реакции образования трет-бутилбромида зависит только от концентрации спирта и не зависит от концентрации галогеноводорода, что характерно для реакций мономолекулярного нуклеофильного замещения SN1.
В реакциях спиртов, протекающих по механизму SN1, реакционная способность уменьшается в следующем ряду:
аллиловый спирт ≈ бензиловый спирт > третичные > вторичные
Этот ряд соответствует ряду снижения термодинамической устойчивости карбокатионов, образующихся в медленной стадии процесса. Первичные карбокатионы и метил-катион наименее устойчивы и из первичных спиртов образуются крайне медленно. Поэтому первичные спирты по механизму SN1 реагируют лишь в исключительных случаях (см. ниже пример изомеризации неопентилового спирта в присутствии HCl).

16.4. Реакции |
345 |
Перегруппировка является результатом быстрого превращения промежуточно образующегося вторичного карбокатиона в более стабильный третичный карбокатион вследствие быстрой миграции атома водорода с парой электронов — гидрид-иона. Факт перегруппировки обычно рассматривают как серьезное доказательство реакции спирта по механизму SN1. Как уже отмечалось в разд. 13.4.2, миграцию гидрид-иона называют гидридным сдвигом. Например, гидридный сдвиг наблюдается при обработке 3-метил-2-бутанола хлороводородом. В этом случае механизм реакции включает 1,2-гидридный сдвиг.
|
|
|
|
|
|
|
|
|
|
|
δ |
|
δ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СH3 |
|
CH |
|
CH |
|
|
CH3 |
H |
Cl |
|
|
|
СH3 |
|
|
|
|
CH |
|
|
CH |
|
|
CH3 |
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— H2O |
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
CH3 OH |
|
|
|
|
|
|
|
|
|
|
CH3 |
O |
|
|
|
|
|
|
|
|
медленно |
|||||||||||||||||||||||||||||||||||||||||
3-метил-2-бутанол |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
H |
|
|
CH3 |
|
|
~ H |
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
C |
|
|
|
CH |
|
|
CH3 |
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
СH3 |
|
C |
|
|
|
|
|
СH3 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
вторичный карбокатион |
|
|
|
|
|
|
|
|
|
переходное состояние |
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,2-гидридного сдвига |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
CH3 |
|
|
Cl |
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СH3 |
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
СH3 |
|
C |
|
CH2 |
|
CH3 |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
третичный карбокатион |
|
|
|
|
|
|
|
|
|
|
2-метил-2-хлорбутан |
||||||||||||||||||||||||||||||||||
Стабилизация карбокатиона может достигаться не только путем гидридного сдвига, но и перемещением алкильной группы в виде карбаниона. Классическим примером такой перегруппировки является превращение неопентилового спирта в присутствии HCl:
|
|
|
|
CH3 |
|
|
|
|
|
Cl |
|
|||||||
CH3 |
|
|
|
HCl |
|
|
|
|
|
|
|
+ H2O |
||||||
|
C |
|
CH2OH |
|
|
CH3 |
|
C |
|
CH2 |
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
CH3 |
|
|||||||||
неопентиловый спирт |
|
|
|
2-хлор-2-метилбутан |
|
|||||||||||||
Неопентиловый спирт является первичным спиртом. Из-за стерических затруднений он не вступает в реакции SN2, но медленно реагирует по механизму SN1. Образующийся при этом первичный карбокатион быстро перегруппировывается в более стабильный третичный карбокатион за счет
346 Глава 16. Спирты
1,2-сдвига метильной группы с парой электронов. Такой сдвиг изменяет углеродный скелет молекулы.
|
|
|
|
CH3 |
δ |
|
δ |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
H |
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
CH3 |
|
C |
|
CH2OH |
|
|
|
|
CH3 |
|
|
|
C |
|
|
|
|
CH2 |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
–H2O |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
неопентиловый спирт |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
~CH3 |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
≠ |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
C |
|
|
CH2 |
|
|
|
CH3 |
|
C |
|
|
|
CH2 |
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
первичный карбокатион |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(малоустойчив) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
CH2 |
|
|
CH3 |
|
|
|
Cl |
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
C |
|
CH2 |
|
CH3 |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
третичный карбокатион |
|
|
|
|
|
|
|
2-метил-2-хлорбутан |
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(устойчив) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
Спирты с циклоалкильной группой, находящейся у того же атома углерода, что и гидроксигруппа, часто подвергаются перегруппировкам с расширением цикла:
H |
|
CH3 |
|
Cl |
||
|
||||||
|
|
|
|
OH + HCl |
|
CH3 |
C |
|
|
||||
|
|
|||||
|
|
CH3 |
|
CH3 |
||
|
||||||
2-циклобутил- |
|
2,2-диметил- |
||||
2-пропанол |
|
1-хлорциклопентан |
||||
Реакция включает промежуточное образование карбокатиона, который перегруппировывается в циклопентильный катион:
H CH3 |
|
H CH3 |
|
H |
||||||
|
|
|
|
|
|
|
|
CH3 |
||
C |
|
OH |
|
C |
|
|||||
|
|
|||||||||
|
2 |
|
|
|
|
|
Cl |
|||
|
|
|
|
–H2O |
|
|
|
|
||
CH3 |
CH3 |
CH |
||||||||
|
|
|||||||||
|
|
|||||||||
|
|
|
|
|
|
|
3 |
|
||
|
|
|
|
|
|
|
|
Cl |
||
CH3
CH3
Движущей силой такой перегруппировки является снятие напряжения С4-цикла при превращении его в С5-цикл.


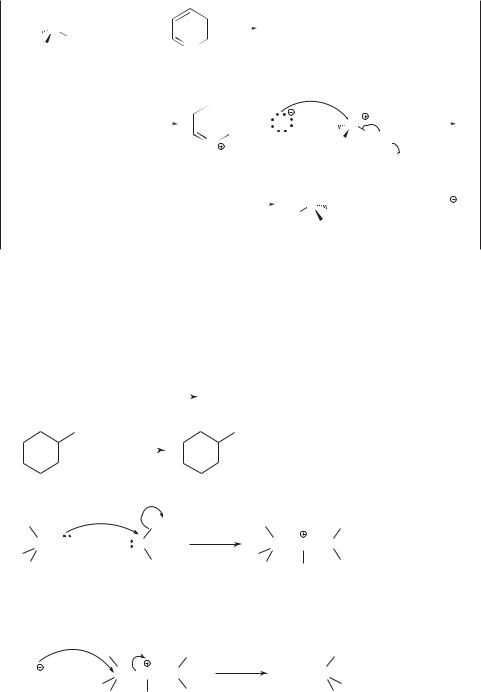
16.4. Реакции |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
349 |
|||||
|
|
|
CH3 |
+ PCl5 |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2H5 |
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
(R)-2-бутанол |
|
пиридин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
(основание) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
SN2 |
|
|
|
|
|
|
|
|
|
|
|
|
+ |
Cl |
+ H |
|
δ |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
нуклеофил |
|
|
O |
PCl3 |
|
|
|
||||||
|
|
|
|
|
|
|
N |
|
C2H5 |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
+ POCl3 |
+ Cl |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
C |
H |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(S)-2-хлорбутан
Оптически активные третичные спирты реагируют в этих условиях с преимущественной рацемизацией, что согласуется с механизмом SN1, т. е. с промежуточным образованием карбокатиона.
Реакция спиртов с PBr3 — один из лучших способов получения бромалканов. Если реакция проводится при температуре не выше 0 °С, она не осложнена перегруппировочными процессами, отмеченными для реакций спиртов с HBr, и протекает с высоким выходом продукта:
3ROH + PBr3 |
|
|
|
3RBr |
+ H3PO3 |
|
|
|
|
||||
OH |
|
|
|
Br |
|
|
|
|
PBr3 |
|
(70%) |
||
|
|
|
|
|
|
|
Эта реакция начинается с нуклеофильной атаки спирта по атому фосфора:
Br |
|
Br |
C—OH + P—Br |
C—O—P |
|
Br |
H |
Br |
|
A |
|
В зависимости от строения спирта интермедиат А — протонированный алкилдибром-фосфит далее реагирует по типу SN2 (т. е. с обращением конфигурации у атома углерода) с бромид-ионом
|
Br |
Br + C—O—P |
Br—C + HOPBr |
|
2 |
HBr

350 |
|
|
|
|
|
Глава 16. Спирты |
или подвергается ионизации по типу SN1 |
|
|
||||
|
Br |
|
|
Br |
||
C—O—P |
|
–HOPBr2 |
—C |
|
||
|
|
|
|
Br—C |
||
|
|
|
|
|||
HBr
Образующийся НОPBr2 реагирует затем по схеме, аналогичной для PBr3, со второй молекулой спирта. Точно также образующийся при этом (НО)2P—Br реагирует затем с третьей молекулой спирта.
РЕАКЦИИ С SOCl2
Эта реакция интересна тем, что в зависимости от условий проведения она может протекать с обращением или с сохранением конфигурации у хирального атома углерода спирта.
|
|
|
|
|
|
|
SOCl2 |
CH3 |
|
CH |
|
|
CH2CH3 |
+ SO2 |
+ HCl |
||||
|
|
|
|
|
|
|
эфир |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH3 |
|
CH |
|
CH2CH3 |
|
|
|
|
|
Cl |
|
|
|||||||
|
|
|
|
(R)-2-хлорбутан |
|
|
|||||||||||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
OH |
SOCl2 |
CH3 |
|
|
CH |
|
|
CH2CH3 |
+ SO2 |
+ HCl |
||||||||
(R)-2-бутанол |
|
|
|
|
|||||||||||||||
|
|
|
|
||||||||||||||||
пиридин |
|||||||||||||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
||||||
|
|
|
|
|
|
|
|
(S)-2-хлорбутан |
|
|
|||||||||
Механизм реакции в эфире или диоксане получил название «нуклеофильное внутримолекулярное замещение SN i» и включает следующие стадии:
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
эфир |
|
CH3 |
медленно |
|
||||||||||||||||||
|
|
+ Cl |
|
|
|
|
|
|
|
|
|
|
|
|
δ |
|
|
|
|
|
|
|
|
Cl |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
H C |
|
S |
|
Cl |
|
|
|
|
H C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
–HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
C2H5OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
S |
|
|
|
|
|
|
|
|||||||
|
|
O |
|
|
|
|
C2H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
(R)-2-бутанол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
O |
|
|
|
|
|
|
|
|
+ SO2 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
C |
|
|
O |
|
|
|
H |
C |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2H5 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
тесная ионная пара |
|
(R)-2-хлорбутан |
||||||||||||||||||||||
Образование карбокатиона согласуется с экспериментальными данными: чем устойчивее карбокатион, образующийся из спирта, тем легче идет реакция. Однако рацемическая форма, характерная для реакций SN1, при


 CH
CH