
порядка 1·10- 4 %. Этот металл не встречается в виде самородков, только в виде соединений и то редко, например, в составе минерала вольфрамит (Fe – Mn – (0,2 – 2 %)·W – O). Вольфрамовые месторождения РФ — Северный Кавказ, Приэльбрусье. Самые богатые месторождения вольфрама находятся в Китае.
Физические свойства: температура плавления 3380 ° С, плотность 19,3 г/см3 (такая же, как у золота); температурный коэффициент линейного расширения αl = 4·10- 6 К- 1. Предел механической прочности на разрыв больше 1800 МПа. Коэффициент теплопроводности 140 Вт/(м·К). Вольфрам при 20 ° С реагирует со фтором, образуя WF6. При температуре больше 400 ° С взаимодействует с кислородом, при более высоких температурах — с хлором и бромом. Растворяется в смеси азотной и плавиковой кислот (HNO3 + HF).
Электрические свойства: удельное электрическое сопротивление при 20 ° С равно 5·10-8 Ом·м. При 2400 ° С величина ρ возрастает до 85·10- 8 Ом·м. Имеется слабо выраженная сверхпроводимость при 0,01 К при нормальном давлении, макроразмерах и экранировке от магнитного поля Земли.
К достоинствам вольфрама относятся: высокая температура плавления (3380 ° С);
высокая механическая прочность (больше 1800 МПа). Недостатки вольфрама:
дефицитность. В Земной коре содержится 1·10- 4 % вольфрама; окисление в воздушной (кислородной) среде при температуре
более 400 ºС; при использовании при высоких температурах требуется защит-
ная атмосфера.
Применение вольфрама:
вольфрам используется в качестве легирующей добавки для повышения прочности инструментальных сталей. Резцы из такой стали могут эксплуатироваться при температуре «красного каления», т. е. при 800 ° С. Стали, легированные вольфрамом, используются в
143
качестве танковой брони. На вышеперечисленные цели расходуется почти 85 % добываемого вольфрама;
электрические контакты, используемые для высокотоковых и высоковольтных коммутирующих устройств (токи тысячи ампер и напряжения тысячи вольт). Эти контакты выполнены из сплава меди и вольфрама;
электровакуумная техника. Вольфрам используется как высокотемпературный материал для нагревательных катодов, изготовления сетки и т. д.;
электрические печи сопротивления. Вольфрам используется в качестве нагревателя, у которого рабочая температура 2500 ° С, и он может применяться в вакууме или нейтральном газе;
испарители для золота и кремния из вольфрама для создания интегральных схем;
высокотемпературные термопары. Они состоят из вольфрама и рения (Re). У этих термопар рабочая температура 2500 ° С, они могут применяться в вакууме или нейтральном газе;
сосуды из вольфрама для плавки кварцевого стекла с последующим изготовлением оптических волокон;
электрическая лампа накаливания для освещения; электроды для гелиево- и аргонодуговой сварки.
Ниобий. В таблице Д. И. Менделеева ниобий (Nb) находится под № 41 в V группе.
Распространенность в Земной коре 2·10- 4 %. Встречается только в виде химических соединений. Блестящий, серебристый металл. Плотность составляет 8,57 г/см3. Температура плавления 2470 ºС. Удельное электрическое сопротивление при 20 ºС равно 12·10- 8 Ом·м.
Ниобий имеет большое значение в электротехнике, как материал, обладающий наиболее высокой температурой перехода из нормального в сверхпроводящее состояние (9,4 К) среди химических элементов. Поэтому как сам ниобий, так и особенно сплавы на его основе широко применяются для изготовления сверхпроводящих материалов, используемых в промышленности.
144
Проводники различного назначения со средней температурой плавления
К проводникам различного назначения со средней температурой плавления относятся: железо, кобальт, никель, платина, титан и другие химические элементы, у которых температура плавления находится в интервале от 500 до 2500 ° С. (В этом же температурном интервале находятся также серебро, золото и медь, но эти металлы были рассмотрены выше как проводники с высокой электропроводностью).
Железо. В таблице Д. И. Менделеева железо (Fe) находится под № 26 в VIII б группе. Распространенность железа в Земной коре порядка 4,5 %, и оно занимает по этому показателю пятое место среди химических элементов. Среди металлов железо находится на втором месте после алюминия. Железо в Земной коре в основном встречается в виде соединений, таких как оксиды железа (Fe3O4 — магнетит; Fe2O3 — гематит), карбонаты железа (FeCO3), сульфиды железа (FeS2)
идр. Железо самородное встречается очень редко в виде железных метеоритов (это конечный продукт термоядерной эволюции звезд) или так называемого теллурического железа, образующегося в Земной коре в виде мельчайших зерен при остывании основных магм. Метеоритное железо человечеству было известно еще до нашей эры,
ионо в бронзовый век (3 − 2 тысячи лет до н. э.) ценилось даже выше, чем бронза или медь. Физические свойства железа: температура плавления 1535 ° С, плотность 7,87 г/см3. Железо высокой чистоты — блестящий, серебристый металл.
Магнитные свойства железа: одна из кристаллических структур железа (феррит) является ферромагнетиком, у которого температура Кюри составляет 769 ° С.
Удельное электрическое сопротивление железа при 20 ° С равно
10·10- 8 Ом·м.
Железо используется в качестве сплавов с углеродом (для производства сталей и чугунов). Сталь содержит менее 2,14 % углерода (конструкционная сталь — менее 0,7 %), в чугуне содержание
145
углерода (2,14 ÷ 6,0) %. Чистое железо применяется в порошковой металлургии, в частности для изготовления магнитных материалов из карбонильного и электролитического железа. Предел механической прочности мягкой отожженной стали равен 700 – 800 МПа; у твердой неотожженной стали при добавлении легирующих добавок (вольфрам, молибден, хром, марганец и др.) — порядка 1000 – 1750 МПа. Железо реагирует с кислородом и водой, при этом на поверхности образуется слой, называемый при низких температурах — « ржавчина», при высоких — « окалина». Коррозионная стойкость железа к кислороду в 3 раза меньше, чем у меди. Порядка 10 % железа с течением времени переходит в ржавчину.
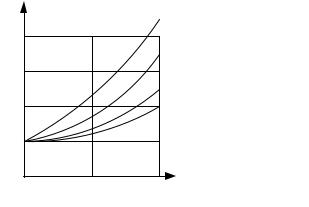
Зависимость удельного электрического сопротивления железа от примесей представлена на рис. 5.15.
ρ ×108 (Ом× м)
Рис. 5.15. Зависимость удельного сопротивления железа от примесей
Из данных, приведенных на рисунке, видно, что введение углерода относительно слабо (по сравнению с примесью кремния) влияет на удельное электрическое сопротивление железа. Поэтому для уменьшения потерь на вихревые токи в состав железоуглеродистого сплава (сталь) вводят кремний. (Так получают широко распространенный магнитомягкий материал — электротехническую кремнистую сталь).
Достоинства железа:
высокая распространенность в Земной коре (порядка 4,5 %);
146
высокие механические свойства (σр может достигать 1750 МПа). Недостаток железа — низкая коррозионная стойкость.
Железо и железоуглеродистые сплавы применяются как проводниковые, магнитные и конструкционные материалы.
Применение в качестве проводников:
для ЛЭП на коротком расстоянии, так как при этом можно применить провод с большим диаметром, и тем самым уменьшить его сопротивление;
для электротранспорта, где функцию одного из проводников выполняют рельсы, у которых большое сечение, и, следовательно, низкое сопротивление;
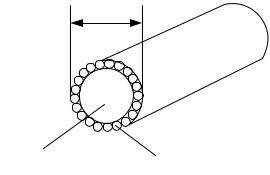
алюмостальные провода (рис. 5.16) для ЛЭП большой дальности, в которых стальной трос используется для увеличения механической прочности конструкции. Увеличение диаметра провода приводит к уменьшению напряженности электрического поля вблизи поверхности комбинированного провода, следовательно, уменьшается вероятность образования короны. За счет введения стального троса можно увеличить расстояние между мачтами ЛЭП, что удешевляет стоимость ЛЭП в целом.
Применение в качестве магнитных материалов: электротехническая кремнистая сталь; сплавы (пермаллои, альни, альнико, альниси); магнитотвердые и магнитомягкие материалы.
Рис. 5.16. Алюмостальной провод для ЛЭП
147

Конструкционное применение: машиностроение; строительство; наземный и морской транспорт;
корпуса электродвигателей, турбо− и гидрогенераторов и др.; щиты управления; военная техника.
Платина. В таблице Д. И. Менделеева платина (Pt) находится под № 78 в VIII б группе.
Распространенность платины в Земной коре порядка 1·10- 7 %. Этот металл встречается в виде самородков (самый крупный 9 кг, найден на Урале), а также в медно-никелевых месторождениях. В России платину добывают на Норильском медно-никелевом комбина-
те. Ранее добывали на Урале. |
|
|
|
Физические свойства: |
температура плавления 1771 ° С, |
плот- |
|
ность 21,4 г/см3 . Платина — |
металл серебристого цвета. |
|
|
Удельное электрическое сопротивление платины при 20 ° С рав- |
|||
но 10·10- 8 Ом·м. |
|
|
|
Механические свойства: относительное удлинение |
l |
≤ 40% . |
|
|
|
l |
|
Предел механической прочности при разрыве 150 МПа, т. е. меньше, чем у серебра.
Платина не взаимодействует с кислородом, водой, серой, со всеми кислотами, кроме нагретой «царской водки». Взаимодействует при нагреве с газообразным хлором, бромом, фтором, образуя соответствующие соединения (например, хлористую платину при 250 ºС).
Достоинства платины — высокая коррозионная стойкость и высокая температура плавления.
Недостаток платины — дефицитность и отсюда высокая стоимость.
Применение платины: электрические контакты;
148
платиновые пасты для металлизации керамики, используемой в керамических конденсаторах;
нагреватели для лабораторных нагревательных устройств в воздушных и кислородных средах;
тигли для синтеза различных неорганических соединений при высоких температурах. (Например, для синтеза высокотемпературных сверхпроводников);
сосуды для плавки алюмосиликатных стекол, используемых для производства стеклоткани с последующим изготовлением фольгированных диэлектриков и печатных плат;
порошкообразная платина один из лучших адсорбентов для газообразного водорода: так, одна часть платины может поглотить 100 частей водорода, а при нагреве водород высвобождается из платины;
платиновые термосопротивления для измерения температуры в интервале температур от − 273 до 1063 ° С;
платино-родиевые термопары для рабочего интервала температур от 100 до 1600 ° С, применяются на воздухе и в кислородной среде (марки некоторых платино-родиевых термопар приведены в табл. 5.6);
из платины изготовлен эталон метра, состоящий из сплава платины и 10 % иридия;
платина используется в качестве слитков, хранящихся в банках (первые в мире монеты из платины были изготовлены в России в
XIX веке).
|
|
|
|
|
Таблица 5.6 |
|
Марки некоторых платино-родиевых термопар |
||||
|
|
|
|
|
|
Марка |
|
|
|
Электроды |
Траб, ° С |
ТПП |
|
№ 1 – |
платина |
|
до 1300 ° С |
|
№ 2 – |
платина |
+ 10 % родия |
||
|
|
|
|||
ТПР |
|
№ 1 – платина + 6 % родия |
до 1600 ° С |
||
|
№ 2 – |
платина |
+ 30 % родия |
||
|
|
|
|||
149
Проводники различного назначения с низкой температурой плавления
К проводникам различного назначения с низкой температурой плавления относятся свинец, олово, кадмий, цинк, ртуть, литий и другие металлы, у которых температура плавления меньше 500 ° С. Также в эту группу могут быть отнесены легкоплавкие сплавы, температура плавления которых может быть намного меньше, чем температуры плавления входящих в этот сплав компонентов.
Свинец. В таблице Д. И. Менделеева свинец (Pb) находится под № 82 в IV группе. Содержание в Земной коре 1,4·10- 4 %. Физические свойства свинца: температура плавления 327 ° С, плотность 11,3 г/см3. Это металл темно-серого цвета. Свинец и его соединения ядовиты. Попадая в организм человека, свинец накапливается в костях, вызывая их разрушение.
Удельное электрическое сопротивление свинца при 20 ° С равно 20·10- 8 Ом·м, т. е. приблизительно в два раза выше, чем у железа. Свинец при нормальном давлении и макроразмерах имеет сверхпроводимость при 7,2 К.
Предел механической прочности равен 15 МПа. Свинец мягкий металл, настолько мягкий, что процарапывается ногтем.
Свинец обладает сравнительно высокой коррозионной стойкостью. Он не взаимодействует с кислородом и водой, а также с большинством кислот (кроме азотной (HNO3)) и щелочей.
Применение свинца:
«мягкие» припои (оловянно-свинцовые припои), рабочая температура которых меньше 300 ° С;
плавкие вставки для защиты электротехнических сетей и оборудования;
защитная оболочка некоторых типов силовых кабелей от воздействия океанской воды или грунтовых вод;
150
радиационная защита — защита от ионизирующих излучений высокой энергии, таких как: рентгеновское, протонное, радиоактивное (α, β, γ). По степени защиты 1 мм свинца соответствует 11 мм стали и 110 мм бетона;
пластины для аккумуляторов.
Кроме вышеперечисленных областей, свинец и его соединения имеют широкое применения и в других сферах. (Например, типографский шрифт, пули, подошва ботинок у водолазов, свинцовое стекло и др.).
Олово. В таблице Д. И. Менделеева олово (Sn) находится под № 50 в IV группе. Содержание в Земной коре 2·10- 4. В природе существует десять изотопов олова (максимальное количество среди химических элементов). В России промышленные месторождения олова находятся на Дальнем востоке и в Якутии.
Физические свойства: температура плавления 232 ° С, плотность 7,3 г/см3. Олово — металл белого цвета. В отличие от свинца олово не токсично.
Удельное электрическое сопротивление олова при 20 ° С равно 11·10- 8 Ом·м. Сверхпроводящее состояние наступает при 3,7 К.
Предел механической прочности олова больше, чем у свинца. Олово не взаимодействует с кислородом и водой, а также с большинством кислот.
Применение олова:
«мягкие» припои (оловянно-свинцовые припои), рабочая температура которых меньше 300 ° С;
защита железа от коррозии, так называемая «белая жесть» (на эту защиту расходуется 50 % всего добываемого олова). Олово не токсично, что очень важно в случае применения белой жести для хранения продуктов питания. Обычно расход олова при изготовлении «белой жести» таков: 5 кг олова на 1 т стали;
оловянная бронза (Cu + ≤ 10 % Sn). Широко используется при изготовлении памятников. Например, «Медный всадник» в
151
Санкт-Петербурге изготовлен из бронзы следующего состава:
90 % Cu + 7,5 % Sn + 2,5 % Zn;
антифрикционные сплавы с низким коэффициентом трения, в частности, для электрических машин: (70 – 90) % Sn + Cu + Sb ( сурьма). Это — сплавы с общим названием «баббиты»;
легкоплавкие сплавы с температурой плавления менее Тпл олова, состоящие из свинца, олова, кадмия и висмута (температура плавления каждого компонента в отдельности выше 200 ° С). Например, сплав Вуда, в состав которого входят перечисленные компоненты, имеет температуру плавления приблизительно равную 67 ºС;
сверхпроводник Nb3Sn c Tc равной 18 K, имеющий в настоящее время широкое применение при изготовлении сверхпроводниковых материалов промышленного применения.
Цинк. В таблице Д. И. Менделеева цинк (Zn) находится под № 30 в II группе. Содержание в Земной коре порядка 8·10- 3 %.
Физические свойства: температура плавления 419 ° С, плотность
7,2 г/см3.
Электрические свойства: удельное электрическое сопротивление при 20 ° С равно 5·10- 8 Ом·м.
При 20 ºС цинк хрупок, при сгибании прутка слышен треск, даже более сильный, чем в случае олова. При 150 ºС цинк пластичен. Примеси резко увеличивают хрупкость цинка. Цинк имеет сравнительно высокую коррозионную стойкость к воде и кислороду.
Применение цинка:
«твердые» припои, рабочая температура которых находится в интервале 500 – 800 ° С. Представители твердых припоев, например, припой ПМЦ — медноцинковый, ПСр — припой серебряный, состоящий из серебра, меди и цинка;
латунь (Cu + ≤ 10 % Zn);
защита железа и стали от коррозии; металлизация конденсаторных полимерных пленок и бумаги;
152
