
Полярные молекулы резко различаются по виду и размерам атомов, и по их электроотрицательности. Такие молекулы образуют несимметричную молекулу (электронная пара смещена в сторону более электроотрицательного атома). В результате у полярных молекул
R
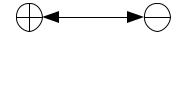
образуется электрический дипольный момент p=q l , где q — электрический заряд; l — расстояние (рис. 3.2):
Рис. 3.2. Схема, поясняющая возникновение дипольного момента
Дипольный момент (p) измеряется в Кл·м или в Дебаях (Д), 1 Д = 3,3·10- 30 Кл·м.
Примеры неполярных и полярных молекул: Н2, Cl2 — неполярные молекулы (р = 0);
HCl (соляная кислота), С-О (оксид углерода), Н2О — полярные молекулы (р больше 0).
Полярные диэлектрики по сравнению с неполярными обладают значительно более низкими диэлектрическими характеристиками. Неполярные вещества применяются как лучшие диэлектрики. Особенно они важны для устройств, работающих в диапазоне сверхвысоких частот (СВЧ). Полярные вещества применяются там, где допустима изоляция среднего уровня.
Ковалентная связь является очень прочной связью. Это подтверждается, например, тем, что у карбида кремния (SiC) температура разложения порядка 2600 ° С; у углерода в модификации алмаза твердость 10 баллов. Приведенные в качестве примера вещества обладают ковалентной связью.
Данный тип связи наблюдается у веществ в газообразном, жидком и твердом состояниях, имеет место, как в диэлектриках, так и в полупроводниках.
33

3.1.2. Ионная связь
Ионная связь (гетерополярная связь) образуется за счет взаимного кулоновского притяжения разноименно заряженных ионов. При этом притяжение разноименно заряженных ионов превышает отталкивание одноименно заряженных. Эта связь наблюдается в, так называемых, ионных кристаллах, которые являются гигантской ассоциацией ионов.
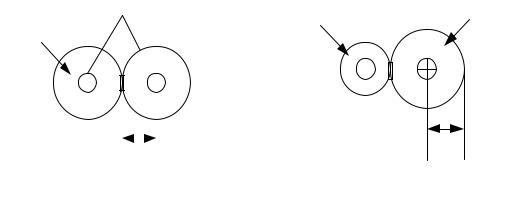
Прочность или энергия (W) ионной связи определяется следую-
щим (рис. 3.3):
взаимным кулоновским притяжением положительных и отрицательных ионов;
отталкиванием внешних электронных оболочек этих же ионов, возникающим при очень малых расстояниях между ионами.
Рис. 3.3. Энергия ионной связи: δ — расстояние между положительными и отрицательными ионами; r0 — равновесное расстояние между положительными и отрицательными ионами
В итоге образуется кристаллическая структура, которая определяется величиной r0, размерами ионов и имеет минимум свободной энергии. Существует семь типов кристаллических решеток:
кубическая; гексагональная; тетрагональная; ромбическая; триклинная; моноклинная;
ромбоэдрическая (тригональная).
34
Ионные кристаллы образуются, в частности, из следующих эле-
ментов: |
|
|
|
|
|
|
|
|
с |
одной |
стороны |
элементы |
I, II |
и |
III |
групп |
таблицы |
Д. М. Менделеева, такие как: Li, Na, K, Be, Mg, Al, Y и др. ; |
|
|||||||
с |
другой |
стороны |
элементы |
VI |
и |
VII |
групп |
таблицы |
Д. И. Менделеева, такие как: О, F, Cl и др. |
|
|
|
|
||||
Таким образом, ионная связь чаще всего образуется между элементами I, II, III и VI, VII групп таблицы Д. И. Менделеева, т. е. соединяются атомы с резко различной электроотрицательностью.
Пример молекул с ионной связью: Li2O, MgO, NaCl и др. Ионная связь так же, как и ковалентная, очень прочная, напри-
мер, температура плавления оксида алюминия (Al2O3) 2040 °C, оксида магния (MgO) 2800 °C, диоксида тория ThO2 3050 °C. Перечисленные в качестве примера материалы имеют ионный тип связи.
На рис. 3.4 приведены для сравнения молекулы фторсодержащих веществ, различающихся видами химической связи (ионной и ковалентной). Из рисунка видно, что радиус атома фтора в молекуле фтора, обладающей ковалентной связью, не равен радиусу иона фтора в молекуле фторида лития, обладающей ионной связью.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а) |
|
|
|
|
|
|
|
|
|
б) |
||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
Рис. 3.4. Фторсодержащие молекулы с ковалентной и ионной связями: а) — молекула фтора (F2), ковалентная связь;
б) — молекула фторида лития (LiF), ионная связь
35

Ионная и ковалентная связи — два крайних вида связи, на практике, как правило, в веществах имеется ковалентная и ионная связи одновременно (смешанная связь) (табл. 3.1). Ионная связь наблюдается в диэлектриках и полупроводниках.
|
|
Таблица 3.1 |
|
Ионность связи |
|
|
|
|
Вещество |
Ионность связи, в долях единицы |
Вид связи |
|
|
|
SiC |
приблизительно 0 |
Ковалентная |
|
|
|
NaCl |
приблизительно 0,94 |
Ионная |
|
|
|
ZnO |
приблизительно 0,62 |
Смешанная |
|
|
|
3.1.3. Металлическая связь
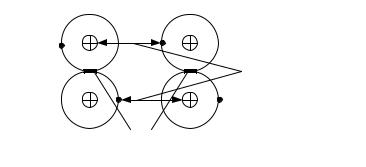
Металлическая связь имеет место в веществах, состоящих из положительно заряженных ионов, находящихся в узлах кристаллической решетки, и квазисвободных (обобществленных, коллективизированных, легко перемещаемых под действием электрического поля) электронов (рис. 3.5).
Рис. 3.5. Схема металлической связи:
Е — напряженность электрического поля; v — скорость
Вещества с металлической связью имеют: высокую электропроводность; высокую теплопроводность;
высокую отражательную способность (блеск);
высокую плотность упаковки (плотность d не менее 22,6 г/см3); пластичность.
36
Вещества, обладающие таким набором свойств, являются ме-
таллами — проводниками (Ag, Cu, Au, Al, Li, Na, Fe и др.).
Металлическая связь, такая же прочная, как ионная и ковалентная, например, температура плавления вольфрама 3380 ° С. Вместе с тем имеются металлы, у которых наблюдается низкая температура плавления Тпл. Например, температура плавления ртути — 39 ° С, це-
зия + 28,5 ° С, галлия + 30,0 ° С.
3.1.4. Молекулярная связь
Молекулярная связь (связь Ван– дер– Ваальса) возникает между молекулами, внутри которых уже имеется ковалентная связь. Эта связь обусловлена синхронным движением внешних валентных электронов, которые в каждый момент времени максимально удалены друг от друга (рис. 3.6). При этом силы притяжения валентных электронов положительно заряженными остовами соседних молекул оказываются сильнее сил взаимного отталкивания электронов внешних орбит.
Рис. 3.6. Схема молекулярной связи
Эта связь слабая, у нее низкая энергия связи. Энергия молекулярной связи приблизительно 0,05 – 0,2 эВ, в то время как, энергия связи молекулы с ионной связью, например, NaCl равна 8 эВ. Молекулярная связь легко разрушается тепловым движением. Так, парафин (СnH2n+2 , где n = 40 – 50), обладающий молекулярной связью, имеет температуру плавления 50 – 52 ° С. Наличие в веществе двух видов связи (ковалентной и молекулярной) приводит к тому, что у вещества наблюдается анизотропия свойств. Молекулярная связь имеет место в диэлектриках: полимеры, твердые Н2, N2, O2, Cl2 и др.
37
3.1.5. Водородная связь
Водородная связь (Н-связь) возникает между двумя электроотрицательными атомами через атом водорода (рис. 3.7). Ее суть заключается в следующем. Атом водорода, ковалентно связанный с электроотрицательным атомом (например, кислородом), несет относительно высокий положительный заряд и электростатически притягивается электроотрицательным атомом другой молекулы с образованием водородной связи.
|
○ |
→│2, 73 А │← |
|
ОH . . . . О |
|
/ |
\\ |
Н – С |
С – Н |
\\ |
/ |
О . . . . НО ○ |
|
|
→│ │← 1 А |
Рис. 3.7. Схема водородной связи
Комплекс, имеющий Н-связь, рассматривается, как система с наиболее энергетически выгодным расположением электронов. Возможность образования Н-связи во многом определяется малым размером атома водорода, позволяющим подойти к другим атомам на очень близкое расстояние. Энергия водородной связи зависит от электроотрицательности атомов и характерна для групп типа: - ОН, -NH и др. Для образования водородной связи электроотрицательные атомы должны
сблизиться на определенное расстояние порядка (0.25 – 0.30) |
нм. По |
|||
энергии Н-связи условно |
подразделяют |
на «слабые» |
(менее |
|
15 |
кДж/моль), «средние» (15 |
– 30 кДж/моль) |
и «сильные» (до 60 – |
|
80 |
кДж/моль). В органических соединениях Н-связи обычно относятся к |
|||
слабым и средним, но и они достаточно сильны (особенно в целлюлозе).
3.2. ЭЛЕМЕНТЫ ЗОННОЙ ТЕОРИИ ТВЕРДОГО ТЕЛА
Электроны в атоме могут занимать только определенные разрешенные орбиты. Иными словами, электроны находятся на определенных энергетических уровнях, что иллюстрируется энергетической
38
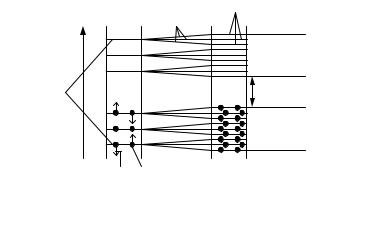
диаграммой (рис. 3.8). При этом, чем дальше от атомного ядра находится электрон, тем больше его энергия.
Согласно принципу Паули, сформулированному крупнейшим физиком-теоретиком ХХ века В. Паули, на каждом энергетическом уровне может находиться не более двух электронов с антипараллельными спинами. Подобное утверждение вытекает из общей формулировки принципа Паули: в любом заданном состоянии может находиться не более одного электрона, определенного квантовыми числами: l, n, m, s. l, n, m — определяют орбиту электрона в атоме; s — определяет спин электрона (↓↑).
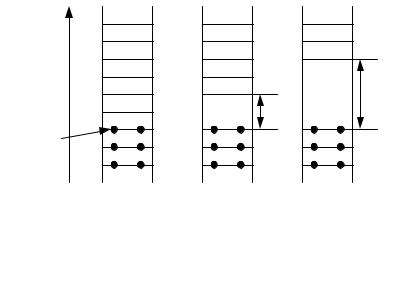
Если в случае изолированного атома электроны занимают определенные энергетические уровни, то в твердом теле вследствие взаимного влияния всей совокупности электронов уровни расщепляются на подуровни и образуются зоны — заполненная (валентная), запрещенная (энергетическая щель) и свободная (зона проводимости) (рис. 3.8).
Электрон в свободной зоне более слабо связан с ядром, т. е. он «квазисвободен». Отсюда следует второе название зоны — « зона проводимости». Зоны могут перекрываться или заполняться частично, что характерно для проводников, имеющих высокую концентрацию квазисвободных электронов.
Рис. 3.8. Энергетическая диаграмма для изолированного атома и для твердого тела: N — количество атомов
Ширина запрещенной зоны ( W) важная характеристика материала. W измеряется в электрон-вольтах [эВ]. 1 эВ = 1,6·10- 19 Дж —
39
это энергия, которую приобретает электрон, проходя в пространстве расстояние между точками, разность потенциалов которых равна 1 В. По величине W электротехнические материалы можно разделить на проводники, полупроводники и диэлектрики (рис. 3.9).
Рис. 3.9. Энергетические диаграммы для ЭТМ: n — концентрация квазисвободных электронов
В табл. 3.2 представлены сводные данные, характеризующие ЭТМ с учетом W и классификации по поведению ЭТМ в электрическом поле.
|
|
|
|
|
|
Таблица 3.2 |
|
Классификация ЭТМ |
|
|
|||
|
|
|
|
|
||
Тип ЭТМ |
ρv, Ом·м |
W, эВ |
Тип носителя |
Характер |
||
|
(20 ° С) |
|
заряда |
проводимости |
||
Проводник |
менее 10- 5 |
0 |
Электрон |
Металлический |
||
Полу- |
10- 6 – 10 9 |
менее 3 |
Электрон |
|
|
|
проводник |
|
|
|
|
Полупроводнико- |
|
|
|
|
При |
низких |
||
|
|
|
вый |
или диэлек- |
||
|
|
|
температу- |
трический (для об- |
||
|
более 108 |
|
рах — |
ион, |
||
Диэлектрик |
3 – 10 |
ласти |
собственной |
|||
|
|
|
при |
высо- |
проводимости) |
|
|
|
|
ких — |
элек- |
|
|
|
|
|
трон + ион |
|
|
|
40
4.ДИЭЛЕКТРИКИ
4.1.ОБЩИЕ СВЕДЕНИЯ И КЛАССИФИКАЦИЯ ДИЭЛЕКТРИКОВ
Термин «диэлектрик» ввел М. Фарадей в 1839 году. Отличительной чертой этих материалов, которые могут быть в твердом, жидком и газообразном состоянии, является практически полное отсутствие носителей электрического заряда, поэтому удельное электрическое сопротивление диэлектриков достигает 1016 – 10 17 Ом·м. Иными словами, диэлектрик — вещество, практически не проводящее электрический ток. Концентрация свободных носителей заряда в диэлектрике не превышает 108 см− 3 . Основное свойство диэлектрика состоит в способности поляризоваться во внешнем электрическом поле. С точки зрения зонной теории твердого тела диэлектрик — вещество с шириной запрещенной зоны больше 3 эВ. Все диэлектрические материалы условно подразделяются на две группы: активные и пассивные.
Пассивные диэлектрики используются в качестве изоляционных материалов, задача которых состоит в воспрепятствовании прохождения току нежелательными путями. Однако, по определению диэлектрики — это вещества, основным электрическим свойством которых является способность поляризоваться под действием электрического поля. Таким образом, пассивные диэлектрические материалы выполняют двойную функцию: изоляционную и накопительную (за счет поляризации происходит запасание электрической энергии).
Классификация диэлектриков по происхождению:
натуральные (целлюлоза, мрамор, воск, масла, слюда, каучук и т. д.);
синтетические или искусственные (многие полимеры, стекло, каучук, масла и т. д.).
Классификация диэлектриков по химической природе:
41

органические (соединения углерода, которые могут содержать водород, азот, кислород, серу и т. д.);
неорганические (кварц, стекло, керамика, мрамор, слюда); композиционные или составные, т. е. состоящие из органическо-
го связующего и органического или неорганического наполнителя, например, гетинакс, текстолит, стеклотекстолит лакоткань.
Классификация диэлектриков по агрегатному состоянию: газообразные (углеводороды, например, метан СН4, а также не-
органические газы); жидкие (например, нефтяные масла, такие как трансформатор-
ное, кабельное и конденсаторное); твердые (высокомолекулярные вещества — смолы и полимеры,
атакже керамика, стекло и слюда).
4.2.СВОЙСТВА ДИЭЛЕКТРИКОВ
4.2.1. Поляризация
Поляризация — процесс ограниченного смещения связанных электрических зарядов под действием электрического поля, при этом электрический момент диэлектрика становится не равным нулю.
Количественной характеристикой интенсивности процесса поляризации служит дипольный момент единицы объема диэлектрика, который называется поляризованностью:
|
|
∑ pi |
|
|
|
P= lim |
|
i |
|
, |
(4.1) |
V→0 |
|
|
V |
|
|
|
|
|
|
|
|
где V — единичный объем диэлектрика; рi — |
дипольный момент |
i-й частицы. |
|
Для пассивных (линейных) диэлектриков поляризованность |
|
пропорциональна напряженности внешнего электрического поля: |
|
P = ε0 χE , |
(4.2) |
42
