
- •На тему: Определение содержания NaOh и Na2co3 при совместном присутствии. Статистическая обработка результатов анализа
- •1 Этап. Подготовка контрольного раствора образца.
- •2 Этап. Титрование контрольного раствора рабочим раствором кислоты.
- •3 Этап. Расчет содержания NаОн и Na2co3 в контрольном растворе.
- •4 Этап. Обработка результатов анализа, полученных подгруппой, методами математической статистики
1 Этап. Подготовка контрольного раствора образца.
1.Получите в чистую мерную колбу (Vм.к. = 100 мл) раствор, содержащий NаОН и Na2CO3. Добавьте дистиллированной воды до метки по нижнему мениску, закройте колбу пробкой и тщательно перемешайте, переворачивая и встряхивая колбу 30-40 раз, пробку придерживая пальцем.
2 Этап. Титрование контрольного раствора рабочим раствором кислоты.
2. Заполните бюретку рабочим раствором соляной кислоты с известной концентрацией: NHCl·=0.10605.
4. Подготовьте пипетку на 10,0 мл (Vпип), пипетку ополосните трижды контрольным раствором, который приготовили. В две колбы для титрования пипеткой на 10,0 мл отберите аликвоты контрольного раствора, закройте колбы крышками.
5. В первую колбу прилейте 8-9 капель фенолфталеина, цвет раствора в колбе становится ярко-малиновым. Раствор в первой колбе титруйте соляной кислотой до тех пор, пока цвет раствора в колбе не станет бледно-розовым от одной капли HCl.
Внимание! При проведении анализа следует соблюдать следующие условия:
а) контрольный раствор должен быть закрыт пробкой;
б) тотчас же титровать взятый объем раствора;
в) в конце титрования с фенолфталеином прибавлять кислоту медленно, чтобы предотвратить образование вместо NaHCO3 свободной H2CO3;
г) избегать сильного перемешивания раствора, способствующего поглощению СО2 из воздуха.
6. Запишите по бюретке объем кислоты, пошедший на титрование 1/2 Na2CO3 и всей щелочи (Vфф).
7. Затем к этому оттитрованному раствору прилейте одну каплю метилового оранжевого, при этом раствор в колбе окрасится в желтый цвет. Не доливая раствор кислоты в бюретку до "0", продолжайте титрование до перехода желтой до неисчезающей оранжевой окраски раствора.
8. Запишите объем соляной кислоты по бюретке от нулевой метки, пошедший на титрование всего количества соды и щелочи (Vмо).
9. Повторите аналогичное титрование контрольного раствора во второй колбе. Запишите объемы кислоты Vфф1 и Vмо1.
3 Этап. Расчет содержания NаОн и Na2co3 в контрольном растворе.
10. Рассчитайте массу (мг) соды и щелочи следующим образом:
Из данных титрования по двум колбам найти среднее арифметическое (Vфф(сред.))=8.4+8.4/2=8.4 между Vфф и Vфф1, а также Vмо(сред.)=(10.1+10.2)/2=10.15 между Vмо и Vмо1.
Рассчитайте объем соляной кислоты (V3), пошедший на титрование Na2CO3 по 1 стадии:
V3 = [Vмо(сред.) – Vфф(сред.)]=10.5-8.4=1.75
Рассчитайте объем кислоты V4, пошедшей на титрование Na2CO3 по двум стадиям:
V4 = 2[Vмо(сред.) – Vфф(сред.)]=1.75*2=3.5
Рассчитайте объем кислоты V5, пошедшей на титрование щелочи:
V5= Vмо(сред.) - V4=10.15-3.5=6.65
Рассчитайте массу соды в мг в объеме мерной колбы по формуле:
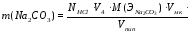 =53*100*3.5*0.10605/10=196.7
=53*100*3.5*0.10605/10=196.7
где M(ЭNa2CO3) = ½ M(Na2CO3) = 106/2 = 53 г/моль(экв) — молярная масса эквивалента Na2CO3;
Vмк — объем мерной колбы.
Рассчитать массу щелочи в мг в объеме мерной колбы:
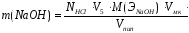 =40*100*6.65*0.10605/10=288.1
=40*100*6.65*0.10605/10=288.1
где M(ЭNaOH) = M(NaOH) = 40 г/моль(экв) — молярная масса эквивалента NaOH.
4 Этап. Обработка результатов анализа, полученных подгруппой, методами математической статистики
Статистическая обработка и представление результатов анализа
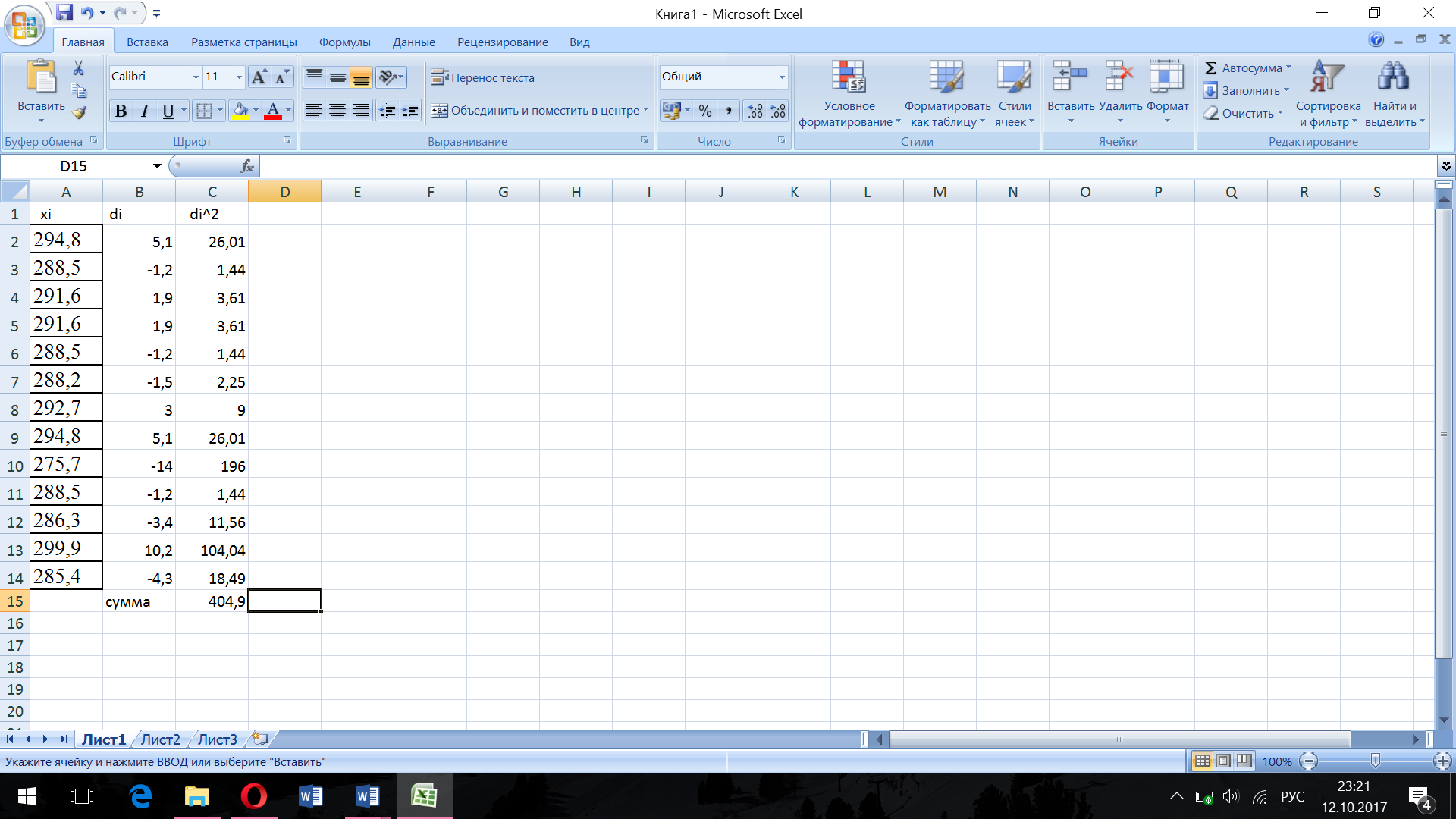
11. Составьте таблицу по результатам титрования всех студентов подгруппы.
|
№ пп |
Фамилия И.О. студента |
m(NaOH) |
m(Na2CO3) |
Примечание* |
|
1 |
Аль-Шишани |
294.8 |
185.5 |
|
|
2 |
Бикбулатов |
288.5 |
185.5 |
|
|
3 |
Валиева |
291.6 |
193.9 |
|
|
4 |
Галин |
291.6 |
185.5 |
|
|
5 |
Камалова |
288.5 |
196.7 |
|
|
6 |
Корнаухова |
288.2 |
196.7 |
|
|
7 |
Макашева |
292.7 |
185.5 |
|
|
8 |
Рамазанов |
294.8 |
185.5 |
|
|
9 |
Султанова |
275.7 |
213.6 |
|
|
10 |
Таспаева |
288.5 |
193.9 |
|
|
11 |
Фахрутдинова |
286.3 |
199.5 |
|
|
12 |
Хлыбов |
299.9 |
183.2 |
|
|
13 |
Чванова |
285.4 |
198.7 |
|
|
*укажите промахи |
||||
9. Произведите статистическую обработку результатов, полученных подгруппой
Итоговая таблица
|
Статистическая характеристика |
m(NaOH) |
m(Na2CO3) |
|
xi |
285,4 |
198.7 |
|
п |
13 |
13 |
|
|
289.7 |
192.6 |
|
s |
5.804 |
8.676 |
|
∆ |
3.511 |
5.245 |
|
|
(286.2;293.2) |
(187.4;197.8) |
|
ε |
1.211% |
2.723% |
Нормальная концентрация.
n=13;
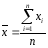
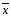 (NaOH)
= 3766.5/13=289.7
(NaOH)
= 3766.5/13=289.7
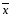 (Na2CO3)
= 2503.7/13=192.6
di
= xi
-
(Na2CO3)
= 2503.7/13=192.6
di
= xi
-
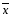
2.
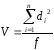 V=404.9/12=33.74
V=404.9/12=33.74
3.
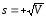 S=5.808
S=5.808
4. 3s=17.42
5. |di| ≤ 3s условие выполняется, следовательно, d грубый промах, который исключается из общей выборочной совокупности. n=12
di
= xi
-
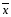
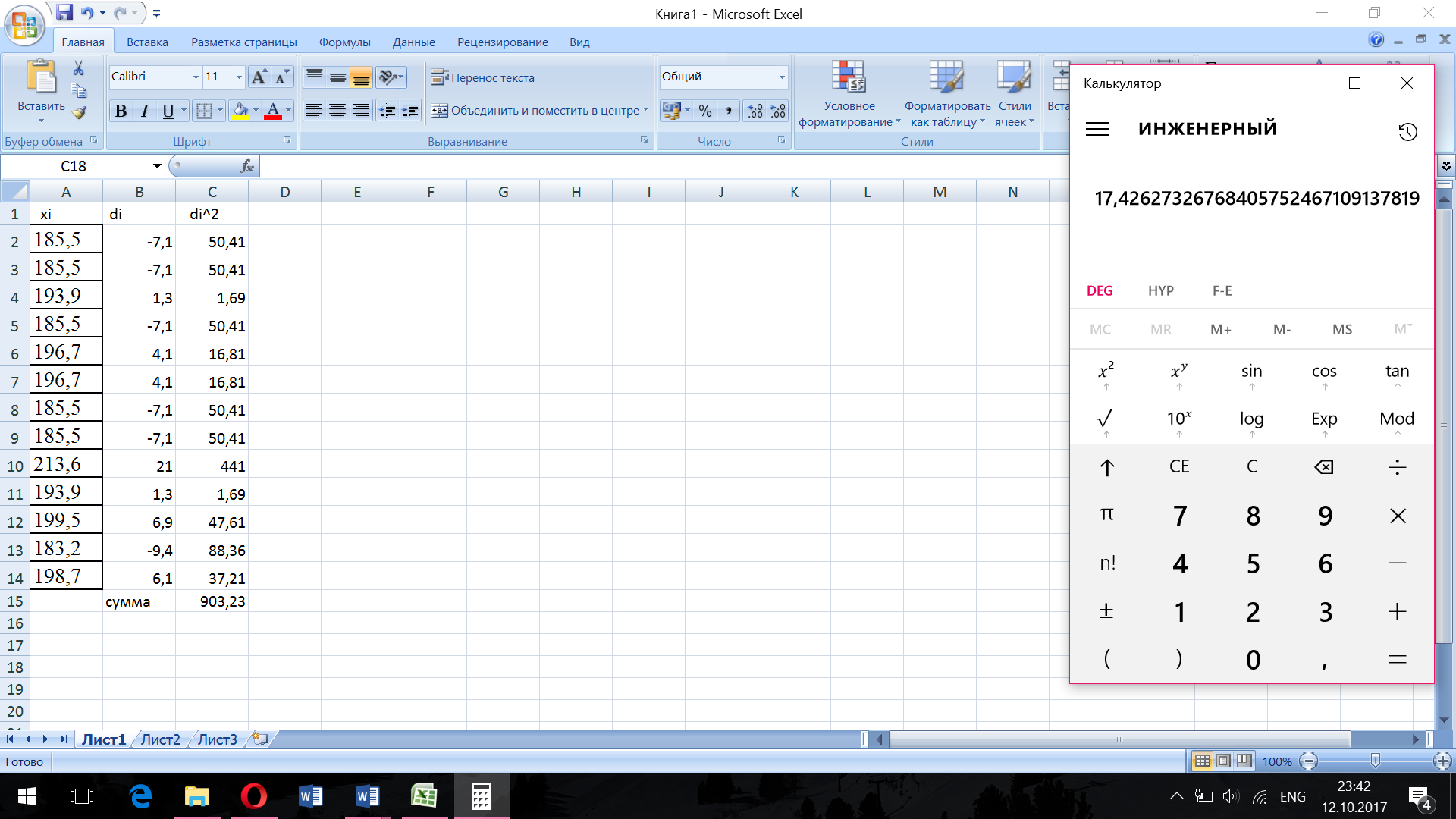
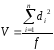 =903.23/12=75.27
=903.23/12=75.27
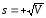 =8.676
=8.676
|di| ≤ 3s 3s=26.03 Условие выполняется,следовательно промахов нет.
∆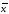 =
=
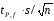
∆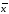 (NaOH)=2.18*5.808/3.606=
3.511
(NaOH)=2.18*5.808/3.606=
3.511
∆ (Na2CO3)=2.18*8.676/3.606=5.245
(Na2CO3)=2.18*8.676/3.606=5.245
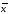 ± ∆
± ∆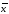
1) 289.7±3.511=(286.2;293.2)
2)192.6±5.245=(187.4;197.8)
ε
= (∆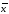 /
/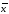 )∙100%.
)∙100%.
1) ε=3.509/289.7*100%=1.211% 2) ε =5.245/192.6*100%=2.723%
Вывод: Была освоена методика проведения титрования с применением двух индикаторов, расчет результатов титрования с фиксированием двух точек эквивалентности; Определи содержание NaOH и Na2CO3 в контрольном растворе; проведена обработка результатов анализа полученных подгруппой, методами математической статистики, в ходе анализа не было грубых ошибок , освоена методика анализа каустической и кальцинированной соды.

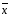
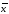
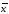 ± ∆
± ∆