
БТПп2 / химия 3 семестр . Аналитика / лабы / ЛР 9 Корнаухова БТПп-16-01
.docxУфимский государственный нефтяной технический университет
Кафедра «Общая, аналитическая и прикладная химия»
Дисциплина «Аналитическая химия»
ОТЧЕТ
по лабораторной работе № 9
на тему: Определение общей жесткости водопроводной воды
Выполнил(а)
Студент(ка) группы БТПп-16-01 Корнаухова Д.А
Приняла
доцент кафедры ОАПХ Чалова О.Б.
Лабораторная работа № 9
Определение общей жесткости водопроводной воды
Цель работы:
- освоить методику проведения анализа методом комплексонометрии
- освоить расчет результатов прямого титрования по методу комплексонометрии
- определить общую жесткость водопроводной воды.
Для подготовки к лабораторной работе следует использовать материалы лекций [31-33] и «Введение в комплексонометрию».
Теоретическое обоснование работы
Жесткость воды определяется содержанием в ней солей металлов с зарядом катионов n≥2. В природной воде наибольшее содержание «главных ионов»: Ca2+, Mg2+, HCO3-, Cl-, SO42-; в водопроводной воде в некотором количестве могут содержаться ионы Fe2+.
Общая жесткость воды (ОЖ) определяется количеством ммоль эквивалентов всех солей Ca2+ и Mg2+, содержащихся в одном литре природной воды:
 [ммоль(экв)/л],
где
[ммоль(экв)/л],
где
nэкв(Me) — количество эквивалентов солей Ca2+ и Mg2+, моль;
VH2O — объем воды, л
Фактически общую жесткость воды можно представить, через нормальную концентрацию (N(Me)) солей Ca2+ и Mg2+ в природной воде:
 [ммоль(экв)/л].
[ммоль(экв)/л].
Общую жесткость экспериментально определяют методом комплексонометрии титрованием аликвоты воды в присутствии индикатора хромогена черного и аммиачного буферного раствора. При этом в реакцию комплексообразования вступают как катион Ca2+ , так и катион Mg2+.
Me2+
+ [H2Y]2-
 [MeY]2-
+ 2H+
[MeY]2-
+ 2H+
По закону эквивалентов для титрования справедливо соотношение:
nэкв(Me) = nэкв(ЭДТА) = NЭДТА∙VЭДТА, где
nэкв(ЭДТА) — количество эквивалентов ЭДТА
NЭДТА — нормальная концентрация ЭДТА, [моль(экв)/л]
VЭДТА — объем раствора ЭДТА, пошедший на титрование, л
Следовательно, общую жесткость по результатам титрования можно рассчитать по формуле:
 [ммоль(экв)/л]
[ммоль(экв)/л]
Карбонатная (временная) жесткость воды (КЖ) определяется количеством ммоль эквивалентов гидрокарбонатов Ca2+ и Mg2+, содержащихся в одном литре природной воды:
 [ммоль(экв)/л],
где
[ммоль(экв)/л],
где
nэкв(Me(HCO3)2) — количество эквивалентов гидрокарбонатов Ca2+ и Mg2+, моль;
Карбонатную жесткость экспериментально определяют методом нейтрализации титрованием аликвоты воды в присутствии индикатора метилоранжа рабочим раствором сильной кислоты, например соляной. Взаимодействие осуществляется по уравнению реакции:
Me(HCO3)2 + 2HCl → MeCl2 + 2H2CO3
HCO3- + H+ → H2CO3
По закону эквивалентов для титрования справедливо соотношение:
nэкв(Me(HCO3)2) = nэкв(HCl) = NHCL∙VHCl, где
nэкв(HCl) — количество эквивалентов HCl
NHCl — нормальная концентрация HCl, [моль(экв)/л]
VHCl — объем раствора HCl, пошедший на титрование, л
Следовательно, карбонатную жесткость по результатам титрования можно рассчитать по формуле:
 [ммоль(экв)/л]
[ммоль(экв)/л]
Постоянная (некарбонатная) жесткость воды (ПЖ) определяется количеством ммоль эквивалентов сульфатов и хлоридов Ca2+ и Mg2+, содержащихся в одном литре природной воды. Постоянную жесткость рассчитывают из соотношения:
ОЖ = КЖ + ПЖ, следовательно: ПЖ = ОЖ - КЖ
Дайте определения следующих понятий
Для определения общей жесткости проводят комплеконометрическое титрование проводят прямое титрование по методу комплексонометрии.
Определение общей жесткости проводят в присутствии индикатора хромогена черного и аммиачного буферного раствора
Для определения карбонатной жесткости проводят титрование методом нейтрализации
Определение карбонатной жесткости проводят в присутствии метилоранжа
Методика проведения работы
Лабораторная работа состоит из трех этапов:
1этап. Титрование аликвот водопроводной воды раствором ЭДТА.
2.этап. Расчет общей жесткости водопроводной воды
3.этап. Статистическая обработка результатов анализа, полученных подгруппой.
1этап. Титрование аликвоты водопроводной воды раствором ЭДТА.
1. Заполните бюретку рабочим раствором ЭДТА с известной концентрацией: NЭДТА·=0.04708.
2. Подготовьте пипетку на 50,0 мл (VH2O(пип)), пипетку ополосните трижды только водопроводной водой.
3. В две большие колбы (на 250 мл) для титрования пипеткой на 50,0 мл отберите аликвоты водопроводной воды. В обе колбы прилейте по ≈15 мл аммиачного буферного раствора, добавьте по ложечке индикатора хромогена черного до винно-красной окраски средней интенсивности.
4. Раствор в первой колбе титруйте раствором ЭДТА до тех пор, пока цвет раствора в колбе не станет чисто синим без фиолетового или сиреневого оттенка. В конце титруйте медленно, перемешивая каждую каплю.
5. Запишите по бюретке объем ЭДТА, пошедший на титрование (V1=6.25 мл).
6. Повторите аналогичное титрование водопроводной воды во второй колбе. Запишите объем (V2 =6.2 мл) раствора ЭДТА, пошедший на титрование второй колбы.
7. Рассчитайте среднеарифметический объем раствора ЭДТА, пошедший на титрование по формуле:
 =6.225
мл.
=6.225
мл.
2 этап. Расчет общей жесткости водопроводной воды.
8.Рассчитайте общую жесткость водопроводной воды по результатам титрования по формуле:
 =
= =5.861
[ммоль(экв)/л].
=5.861
[ммоль(экв)/л].
3 этап. Обработка результатов анализа, полученных подгруппой, методами математической статистики
Статистическая обработка и представление результатов анализа
9. Составьте таблицу по результатам титрования всех студентов подгруппы.
|
№ |
Фамилия И.О. студента |
ОЖ, ммоль(экв)/л |
Примечание* |
|
1 |
Аль-Шишани |
5.885 |
|
|
2 |
Бикбулатов |
6.058 |
|
|
3 |
Валиева |
5.861 |
|
|
4 |
Галин |
5.909 |
|
|
5 |
Камалова |
5.932 |
|
|
6 |
Корнаухова |
5.861 |
|
|
7 |
Макашева |
5.861 |
|
|
8 |
Рамазанов |
5.885 |
|
|
9 |
Султанова |
5.932 |
|
|
10 |
Таспаева |
5.979 |
|
|
11 |
Фахрутдинова |
5.932 |
|
|
12 |
Хлыбов |
5.861 |
|
|
13 |
Чванова |
5.862 |
|
10. Произведите статистическую обработку результатов, полученных подгруппой, используя материалы
Итоговая таблица
|
Статистическая характеристика |
ОЖ, ммоль(экв)/л |
|
xi |
5.885; 6.058; 5.861; 5.909; 5.932; 5.861; 5.861; 5.885; 5.932; 5.979; 5.932; 5.861; 5.862 |
|
п |
13 |
|
|
5.909 |
|
s |
0.05864 |
|
∆ |
0.03546 |
|
|
5.909 ± 0.036 |
|
ε |
0.6 % |
РАСЧЕТЫ: n=13;

 (ОЖ)
= 76,818/13=5.909
(ОЖ)
= 76,818/13=5.909
di
= xi
-


2.
 V=0.041265/12=0.003439
V=0.041265/12=0.003439
3.
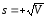 S=0.05864
S=0.05864
4. 3s=0.17592
∆ =
=

∆ =
2.18*0.05864/3.6055=
0.035455
=
2.18*0.05864/3.6055=
0.035455
 ± ∆
± ∆
5.909 ± 0.035455
ε
= (∆ /
/ )∙100%.
)∙100%.
1) ε=0.035455/5.909*100%=0.60002%
Вывод. Была освоена методика проведения анализа методом комплексонометрии; освоен расчет результатов прямого титрования по методу комплексонометрии ,определена общая жесткость водопроводной воды. В ходе расчётов результатов прямого титрования грубых промахов выявлено не было.
Контрольные вопросы.
1. Какие соли присутствуют в природной воде?
2. Присутствие каких солей определяет а) общую жесткость; б) карбонатную (временную) жесткость; в) постоянную жесткость?
3. В каких единицах измеряют жесткость воды?
4. Каким методом экспериментально определяют общую жесткость?
5. В каких условиях проводят определение общей жесткости?
6. Каким методом экспериментально определяют карбонатную жесткость?
7. В каких условиях проводят определение карбонатной жесткости?
8. Как по результатам титрования рассчитать общую жесткость?
9. Как по результатам титрования рассчитать карбонатную жесткость?
10. Как рассчитать постоянную жесткость?



 ±
∆
±
∆