
- •Расчётно-графическая работа
- •1. Расчет начинаем с нахождения термических p, V, t параметров в характерных точках цикла (a, b, c, d):
- •2. Определение значений средних теплоемкостей Cpm и Cvm для каждого процесса.
- •Термодинамический расчет парового цикла
- •1) Определяем с помощью hs-диаграммы и таблиц воды и водяного пара термические p, V, t и калорические h, u, s параметры в характерных точках цикла и заносим их в таблицу 6.
2. Определение значений средних теплоемкостей Cpm и Cvm для каждого процесса.
Средняя массовая изобарная теплоемкость смеси газов для каждого процесса находится по формуле:
 (1)
(1)
где
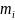 – массовая доля i
– го компонента газовой смеси;
– массовая доля i
– го компонента газовой смеси;
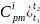 – средняя массовая
изобарная теплоемкость i
– го компонента в интервале температур
от t1
до t2,
определяемая по формуле (2):
– средняя массовая
изобарная теплоемкость i
– го компонента в интервале температур
от t1
до t2,
определяемая по формуле (2):
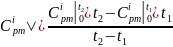 (2)
(2)
где
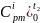 и
и
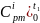 – средние массовые изобарные теплоемкости
i-го
компонента в интервале температур от
0℃ до от t2
до t1,
соответственно, находятся по таблице
7.
– средние массовые изобарные теплоемкости
i-го
компонента в интервале температур от
0℃ до от t2
до t1,
соответственно, находятся по таблице
7.
Таблица 7 Средняя массовая теплоемкость различных газов при при P=const |
|
|
|
|||||
t°C |
o2 |
N2 |
H2 |
СО |
со2 |
S02 |
Н20 |
Воздух |
0 |
0,9148 |
1,0392 |
14,1950 |
1,0396 |
0,8148 |
0,6070 |
1,8594 |
1,0036 |
100 |
0,9232 |
1,0404 |
14,3520 |
1,0417 |
0,8658 |
0,6360 |
1,8728 |
1,0061 |
200 |
0,9353 |
1,0434 |
14,4210 |
1,0463 |
0,9102 |
0,6620 |
1,8937 |
1,0115 |
300 |
0,9500 |
1,0488 |
14,4480 |
1,0538 |
0,9487 |
0,6870 |
1,9192 |
1,0191 |
400 |
0,9651 |
1,0567 |
14,4770 |
1,0634 |
0,9826 |
0,7080 |
1,9477 |
1,0283 |
500 |
0,9793 |
1,0660 |
14,5090 |
1,0748 |
1,0128 |
0,7240 |
1,9778 |
1,0387 |
600 |
0,9927 |
1,0760 |
14,5420 |
1,0861 |
1,0396 |
0,7340 |
2,0092 |
1,0496 |
700 |
1,0048 |
1,0869 |
14,5870 |
1,0978 |
1,0639 |
0,7540 |
2,0419 |
1,0605 |
800 |
1,0157 |
1,0974 |
14,6410 |
1,1091 |
1,0852 |
0,7620 |
2,0754 |
1,0710 |
900 |
1,0258 |
1,1076 |
14,7060 |
1,1200 |
1,1045 |
0,7750 |
2,1097 |
1,0815 |
1000 |
1,0350 |
1,1179 |
14,7760 |
1,1304 |
1,1225 |
0,7830 |
2,1436 |
1,0907 |
1100 |
1,0434 |
1,1271 |
14,8530 |
1,1401 |
1,1384 |
0,7910 |
2,1771 |
1,0999 |
1200 |
1,0509 |
1,1359 |
14,9340 |
1,1493 |
1,1530 |
0,7950 |
2,2106 |
1,1082 |
1300 |
1,5800 |
1,1447 |
15,0230 |
1,1577 |
1,1660 |
- |
2,2429 |
1,1166 |
1400 |
1,0647 |
1,1526 |
15,1130 |
1,1656 |
1,1762 |
- |
2,2743 |
1,1242 |
1500 |
1,0714 |
1,1602 |
15,2020 |
1,1731 |
1,1895 |
- |
2,3048 |
1,1313 |
Процесс a-b:
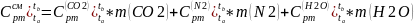


Найдем массовые изобарные теплоемкости каждого компонента данного процесса:
1)
 =
=
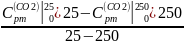
Вычислим:
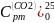 =
=
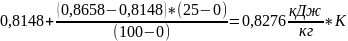
 =
=
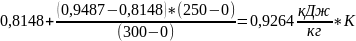
=

2)
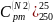 =
=

Вычислим:
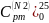 =
=
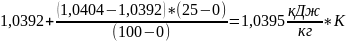
 =
=

=
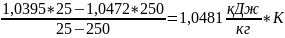
3)
 =
=

Вычислим:
 =
=
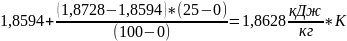
 =
=
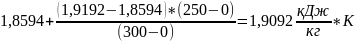
=
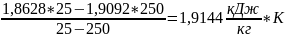
4)
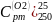 =
=

Вычислим:
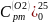 =
=

 =
=
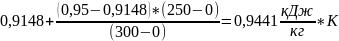
=

Найдем среднюю массовую изобарную теплоемкость смеси газов:

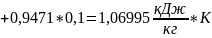
Процесс c-d:

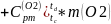 =
=

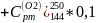
Найдем массовые изобарные теплоемкости каждого компонента данного процесса:
1)
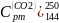 =
=
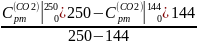
Вычислим:
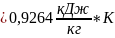
 =
=

=

2)
 =
=
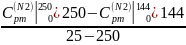
Вычислим:
=

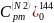 =
=

=

3)
 =
=

Вычислим:
=
 =
=

=
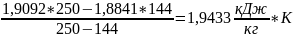
4)
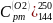 =
=

Вычислим:
=
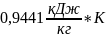
 =
=
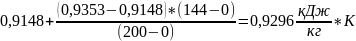
=
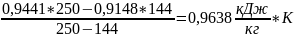
Найдем среднюю массовую изобарную теплоемкость смеси газов:


Процесс b-c:

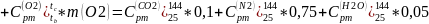

Найдем массовые изобарные теплоемкости каждого компонента данного процесса:
1)
 =
=
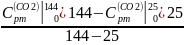
Вычислим:
=
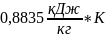
=

=

2)
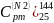 =
=
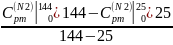
Вычислим:
=
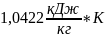
=

=

3)
 =
=
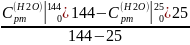
Вычислим:
=

=
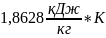
=

4)
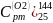 =
=
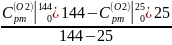
Вычислим:
=
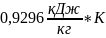
=
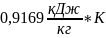
=

Найдем среднюю массовую изобарную теплоемкость смеси газов:
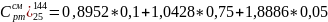

Процесс d-a:

Средние массовые
изохорные теплоемкости
 находятся
из уравнения Майера:
находятся
из уравнения Майера:
 (3)
(3)
Процесс a-b:

Процесс с-d:

Процесс b-c:
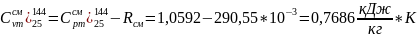
Процесс d-a:
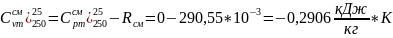
3. Изменения внутренней энергии ΔU и энтальпии Δh для каждого процесса цикла рассчитываются по формулам:
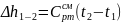 (4)
(4)
 (5)
(5)
Изменения энтропии ΔS для каждого процесса цикла находятся из следующих выражений:
Для изохорного процесса:
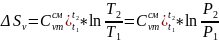 (6)
(6)
Для изобарного процесса:
 (7)
(7)
Для изотермического процесса:
 (8)
(8)
Для адиабатного
процесса

Для политропного процесса:
 (9)
(9)
Процесс a-b:

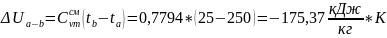
Процесс b-c:
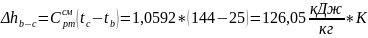

Процесс c-d:


Процесс d-a:
Так как процесс адиабатический S =const, то

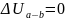
Вычислим изменения энтропии:
Процесс a-b изобарный P=const:

Процесс с-d изобарный P=const:
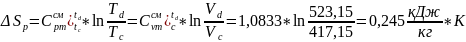
Процесс d-a изотермический T=const:
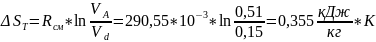
Процесс b-c адиабатический S=const:
Проверка:
Т.к. U, h и S являются функциями состояния, то за весь цикл:
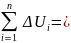 -175,37+91,46+84,03=0
-175,37+91,46+84,03=0
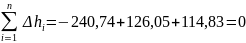
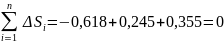
4. Теплота и работа в каждом процессе определяются по следующим формулам:
Процесс a-b изобарный (P=const):
qp
= Δha-b
= -240,74
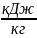
lp = P( Vb – Va) = 3*10-5*(0,29-0,51) = -66
Процесс c-d изобарный (P=const):
qp = Δhc-d = 114,83
lp = P( Vd – Vc) = 10*10-5*(0,15-0,12) = 30
Процесс d-a изотермический (T=const):
qт
= lт
= Rсм*T* =
290,55*10-5*523,15*
=
290,55*10-5*523,15*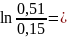 185,72
185,72
Процесс b-c адиабатный (dq = 0):
qaq = 0
laq = -ΔUb-c = -91,46
5. Определим подведенную (в процессе расширения рабочего тела) теплоту q1 и отведенную (в процессе сжатия) теплоту q2 и суммарную работу за цикл с учетом правила знаков для работы (работа расширения положительна, сжатия – отрицательна).
qпол = q1 – q2 = (qc-d + qd-a) – qa-b = (114,83 + 185,72) – 240,74 = 59,81
Суммарная работа lц за цикл:
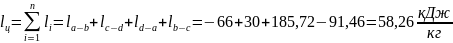
Согласно Ι закону термодинамики для цикла:
qпол = lц
59,81 ≈ 58,26
6. Термический
к.п.д. ( газового
цикла:
газового
цикла:

Таблица 3 Результаты расчетов газовой смеси
Процессы |
n |
Cpm |
Cvm |
ΔU кДж/кг*К |
Δh кДж/кг*К |
ΔS кДж/кг*К |
q кДж/кг |
l кДж/кг |
|||||
кДж/кг*К |
|||||||||||||
a-b |
|
1,06995 |
0,7794 |
-175,37 |
-240,74 |
-0,618 |
-240,74 |
-66 |
|||||
b-c |
|
1,0592 |
0,7686 |
91,46 |
126,05 |
0 |
0 |
-91,46 |
|||||
c-d |
|
1,0833 |
0,7927 |
84,03 |
114,83 |
0,245 |
114,83 |
30 |
|||||
d-a |
|
0 |
-0,2906 |
0 |
0 |
0,355 |
185,75 |
185,72 |
|||||
Σ в цикле |
|
3,212 |
2,05 |
0 |
0 |
0 |
59,81 |
58,26 |
|||||

Рис.4 Газовый цикл
