
Бёккер_Хроматография [2009]
.pdf
320
 Глава 6. Ионная хроматография
Глава 6. Ионная хроматография
гут определяться в одном хроматографическом анализе либо отрицательно, либо положительно заряженные ионы. В двухмерной хроматографии проба идет на две отдельные колонки, поэтому возможно одновременное определение всех ионных компонентов.
В то время как в неорганическом анализе для определения металлов уже дав& но в распоряжении имеется атомная спектроскопия, ионная хроматография зак& рывает пробел, позволяя быстрое и чувствительное определение анионов. Одна& ко по сравнению с атомной спектроскопией у ионохроматографического анализа катионов металлов есть то преимущество, что при этом определяется валентность, соответственно, координационное состояние отдельных катионов. Первая нор& ма немецкого промышленного стандарта (нем.: DIN) для ионохроматографичес& кого определения анионов появилась в 1988 году [6.2].
По механизму разделения можно различить три ионохроматографических метода:
•ион&парная хроматография,
•ионообменная хроматография,
•ион&эксклюзионная хроматография.
Наряду с этим имеются дальнейшие разработки, принцип разделения кото& рых основывается на комбинации ионообменной и обращеннофазовой хроматог& рафии и которые представляют собой разновидность многомерной хроматогра& фии. В большинстве случаев термин «ионная хроматография» используют в уз& ком смысле ионобменной хроматографии.
6.1. Ион'парная хроматография
Ион&парная хроматография – это альтернатива ионообменной хроматографии. Смеси кислот, оснований и нейтральных веществ часто нельзя хорошо разде& лить методами ионного обмена. В этих случаях применяют ион&парную хрома& тографию. При этом в качестве стационарных используются фазы, разработан& ные для обращеннофазовой хроматографии и на которых проводится также наи& большое число хроматографических разделений в ВЭЖХ. Обращеннофазовая хроматография отличается особенной простотой применения при анализе не& полярных соединений. Разумеется, очень многие вещества обладают ионным или сильнополярным характером, а потому часто очень слабо удерживаются на неполярной стационарной фазе или разделяются с недостаточной селективнос& тью. Для решения таких аналитических проблем часто выбирают ион&парную хроматографию [6.3].
В подвижную фазу добавляют органическое ионогенное вещество, которое об& разует ионную пару с противоположно заряженным компонентом пробы. С хими& ческой точки зрения, это соль, которая для хроматографии представляет собой неионную органическую молекулу и может отделяться на обращенной фазе. Поня& тие образования ионной пары пришло из экстракции. Ион&парная экстракция – это техника, которая позволяет добавлением подходящего противоиона перево& дить ионные соединения из водной фазы в органическую фазу.
6.1. Ион%парная хроматография 321
Для удерживания заряженных и, вместе с тем, сильно гидрофильных веществ на неполярной стационарной фазе (обращенная фаза) к подвижной фазе добавля& ют в большинстве случаев органическую соль – так называемый ион&парный реа& гент. В низких концентрациях ион&парные реагенты почти полностью диссоции& рованы. Ионизированные компоненты, подлежащие разделению, образуют с заря& женными органическим ионам ион&парных реагентов ионные пары, которые удер& живаются как незаряженные соединения [6.4]. Ионные пары образуются только при взаимодействии больших органических катионов и больших органических ани& онов. Разделение неорганических ионов с помощью этой техники невозможно.
В качестве ион%парных реагентов для удерживания анионов кислот в общем слу% чае используются тетраалкильные соединения аммония. Для удерживания основных катионов особенно подходят алкилсульфонаты или алкилсульфаты [6.5].
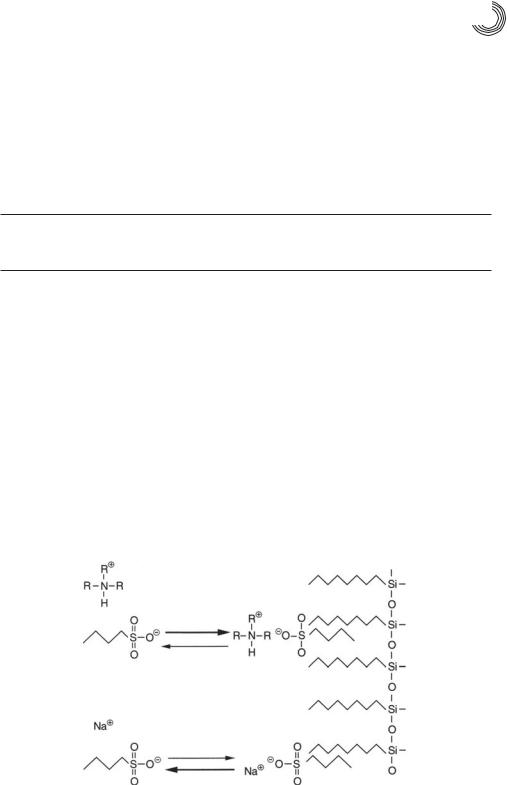
Рис. 6.1 показывает механизм ион&парной хроматографии на примере органи& ческий сульфокислоты. Анионы сульфокислот образуют в подвижной фазе с избыт& ком иона тетраалкиламмония электронейтральную ионную пару, которая может сор& бироваться на гидрофобной поверхности обращеннофазового сорбента. У свобод& ной кислоты или ее натриевой соли вследствие наличия электрического заряда ни& какого взаимодействия со стационарной фазой не происходит, и равновесие в значительной степени смещено в сторону присутствия сульфокислоты в растворе.
Удерживание исследуемых заряженных соединений в обращеннофазовой ион& парной хроматографии зависит от силы их взаимодействия в виде ионных пар со ста& ционарной фазой. Другие ионы, например, ионы буфера и незаряженные соедине& ния, например, молекулы растворителя в подвижной фазе конкурируют с этими ион& ными парами за адсорбцию на свободных активных центрах стационарной фазы.
Для ион&парной хроматографии подходит, в принципе, любая система ВЭЖХ без дополнительных требований к прибору. Уже простой системы, состоящей из
Подвижная фаза |
Стационарная фаза |
Рис. 6.1. Механизм ион&парной хроматографии

322
 Глава 6. Ионная хроматография
Глава 6. Ионная хроматография
насоса, крана&инжектора, хроматографической колонки, детектора и самописца, достаточно для решения большинства задач. Сложные разделения компонентов, сильно различающихся по полярности, требуют оснащения прибора градиент& ной системой элюирования.
В качестве детектора во многих случаях можно использовать проточный УФ фотометр, причем особое внимание нужно обращать на противоион ион&парных реагентов. В то время как ион тетрабутиламмония не поглощает в ультрафиолете, такие противоионы, как бромид или йодид, поглощают ниже 220 нм. Поэтому в качестве противоиона следует выбирать только сульфат.
Ион&парная хроматография на обращенной фазе достаточно проста в приме& нении. Простая наглядная теория дает пользователю возможность целенаправ& ленной оптимизации условий хроматографического разделения. Самые важные правила для этого:
•оптимальный pH подвижной фазы, гарантирующий полную ионизацию разделяемых компонентов;
•рост удерживания с ростом концентрации ион&парного реагента в элюенте;
•рост удерживания с ростом доли воды в элюенте при постоянной концент& рации ион&парного реагента;
•рост удерживания с ростом длины алкильных цепей, т.е. с ростом гидро& фобности, ион&парного реагента при его постоянной концентрации;
•рост удерживания с ростом заряда компонентов пробы при постоянном составе элюента.
6.2. Ионообменная хроматография
Для разделения неорганических катионов и анионов, которые нельзя разделить с помощью ион&парной хроматографии, применяется ионообменная хроматография. При этом разделение анионов – это основная проблема ИХ. В то время как для анализа катионов сегодня имеются производительные методы атомной спектро& скопии, такие как ААС и ИСП&ОЭС, анионы были долгое время предметом особо& го внимания аналитики. Классические методы мокрой химии являются в высшей степени трудоемкими из&за интенсивной пробоподготовки. В противоположность этому ИХ позволяет быстро получить результаты благодаря коротким временам разделения. Разумеется, нужно отметить, что время анализа часто лимитирует не разделение как таковое, а полное элюирование сильно удерживаемых посторонних компонентов матрицы, до того как может быть введена следующая проба. В тече& ние последних лет ни один метод ВЭЖХ не развивался так же быстро, как ИХ [6.6].
Ионообменная хроматография из&за простоты может во многих случаях про& водиться на обычном оборудовании для ВЭЖХ. Для высокочувствительных ана& лизов вплоть до области ультраследовых количеств применяются специальные насосы, у которых головки и все соединения выполнены свободными от нержа& веющей стали. Так как в ИХ наиболее широко применяется детектор по электро& проводности, то лучше всего использовать системы, не содержащие металличес& ких частей, чтобы исключить какие&либо загрязнения.

6.2. Ионообменная хроматография 323
6.2.1.Механизм разделения
Вионообменной хроматографии в качестве стационарной фазы применяется по& лимерная или силикагельная матрица, на поверхности которой привиты кислот& ные или основные группы. Речь идет о ионообменном материале, похожем на тот, что применяется для удаления тяжелых металлов из сточных вод. Различие состо& ит в том, что в технике очистки сточных вод требуется как можно более полное удерживание ионных компонентов, в то время как в ионной хроматографии от& дельные ионы в разной степени связываются с функциональными группами ионообменного сорбента и элюируются подвижной фазой. Для этого требуются специальные ионообменные сорбенты с низкой емкостью и высокой эффек& тивностью.
Вобращеннофазовой хроматографии механизм разделения довольно хорошо может быть описан на основе теории псевдорегулярных растворов с учетом пара& метров растворимости [6.7]. В ионной хроматографии, из&за введения ионных групп и применения в большинстве случаев водной подвижной фазы, взаимодействия коренным образом изменяются. Но и для ионообменной хроматографии были пред& ложены модельные механизмы разделения. Так как детектирование проводится по электропроводности, то представляется разумным использовать в качестве элю& ента высокоочищенную воду, чтобы можно было зарегистрировать, таким обра& зом, самые низкие концентрации ионов в проточной ячейке. Название этой тех& ники разделения говорит о том, что имеет место процесс ионного обмена. Мате& риал ионообменника уже перед вводом пробы нейтрализован противоионами, которые должны находиться и в мобильной фазе. Тогда при вводе пробы проис& ходит обмен ионов подвижной фазы на ионы пробы на ионогенных центрах ионо& обменного материала.
Вкачестве примера более подробно рассмотрим этот процесс еще раз при раз& делении анионов. Колонка наполнена сильноосновной ионообменной смолой.
Вкачестве элюента используется разбавленный водный раствор соли, анионы ко& торого уравновешивают ионообменник в колонке. После ввода раствора пробы анионы из пробы адсорбируются в колонке. Итак, ионный обмен происходит между ионами подвижной и стационарной фаз. Анионы подвижной фазы, кото& рые теперь «обменены» с анионами пробы (отсюда и название «ионообменная хроматография»), мигрируют с катионами пробы по колонке. Так как дальней& ший обмен в колонке происходит только с идентичными анионами, катионы про& бы достигают детектора вместе с фронтом растворителя.
Неудерживаемые катионы пробы вместе с анионами подвижной фазы дости& гают детектора за мертвое время; образуется первый пик, который называется в ИХ часто «пик воды». В зависимости от вида и количества катионов водный пик может давать в итоге отрицательный или положительный сигнал. Адсорбирован& ные анионы тем временем непрерывно обмениваются на анионы подвижной фазы, мигрируют вместе с элюентом и адсорбируют снова на ионите. Таким образом, устанавливается равновесный процесс между адсорбцией анионов из элюента и анионов пробы на ионита, на который накладывается движение подвижной фазы. При этом разделение анионов определяется их сродством к стационарной фазе.

324
 Глава 6. Ионная хроматография
Глава 6. Ионная хроматография
Таблица 6.1. Типичный элюционный ряд для анионов
1. |
Перхлорат |
9. |
Гидрофосфат |
2. |
Фторид |
10. |
Сульфит |
3. |
Ацетат |
11. |
Сульфат |
4. |
Хлорид |
12. |
Иодид |
5. |
Нитрит |
13. |
Хромат |
6. |
Бромид |
14. |
Тиосульфат |
7. |
Цианид |
15. |
Сульфид |
8. |
Нитрат |
16. |
Роданид |
|
|
|
|
Анионы элюируются по очереди согласно своему заряду, диаметру и полярности [6.8]. В табл. 6.1 приведена типичная последовательность элюирования анионов.
Ионный обмен происходит между ионами подвижной и стационарной фаз. Это значит, что при связывании каждого иона пробы со стационарной фазой ос& вобождается один ион буфера и наоборот.
Концентрация ионов в подвижной фазе, проходящей через колонку, постоянна, изменяется лишь идентичность отдельных ионов.
Для детектирования ионов в водном растворе лучше всего подходит измере& ние электропроводности [6.9]. Хотя детектирование по электропроводности по& зволяет чувствительное измерение концентраций ионов в растворе, недостатком ионообменной хроматографии является то, что сам элюент должен быть ионо& генным и поэтому обладает значительной фоновой проводимостью. Изменения проводимости между чистым элюентом и элюентом, содержащим ионы пробы, вследствие этого становятся очень малыми. Это приводит лишь к относительно небольшим сигналам анализируемых ионов на фоне базовой линии с высокой фоновой проводимостью элюента.
Если детектор по электропроводности комбинирует с ионообменной колон& кой, то чувствительность определения зависит от различия в электрофоретичес& кой подвижности между ионами пробы и буфера. Если только эквивалентные проводимости буфера и пробы близки друг к другу, то это приведет к низкой чув& ствительности определения ионов как следствие незначительного изменения в проводимости элюента.
В настоящее время в ионной хроматографии с детектированием по электро& проводности существуют два инструментальных метода подавления проводимос& ти элюента:
•системы с химическим подавлением и
•системы с электронным подавлением.
Первыми коммерчески доступны стали приборы с химическим подавлением. Патентные права фирмы Dionex препятствовали производству и продаже таких систем другими фирмами. Патенты не только защищают рынок для определен& ного изобретения, но также удерживают независимых исследователей от того, чтобы они предпринимали принципиальные улучшения, так как они могли бы достичь финансовых преимуществ и какой&то амортизации своих инвестиций. Наоборот, изобретатели идут на то, чтобы разработать прибор с тем же целевым
6.2. Ионообменная хроматография 325
назначением, но по другой технологии. Поэтому неудивительно, что такие вари& ации встречаются в течение последних лет. Значительное участие в развитии ион& нной хроматографии приняли поставщики устройств с «альтернативной» техни& кой, т.е. с электронным подавлением фоновой проводимости элюента.
Химическое подавление – это в любом случае более эффективный вариант и может применяться вплоть до области ультранизких количеств. Технически проще электронное подавление, которое не подходит для непосредственного определе& ния ультраследовых количеств из&за очень малых различий в измеряемых проводи& мостях, но из&за простоты применения и широкой линейной области является луч& шей альтернативой для многих задач анализа ионов. Оба метода подавления пред& лагаются на рынке фирмой Dionex и в последнее время также фирмой Metrohm.
6.2.2. Химическое подавление
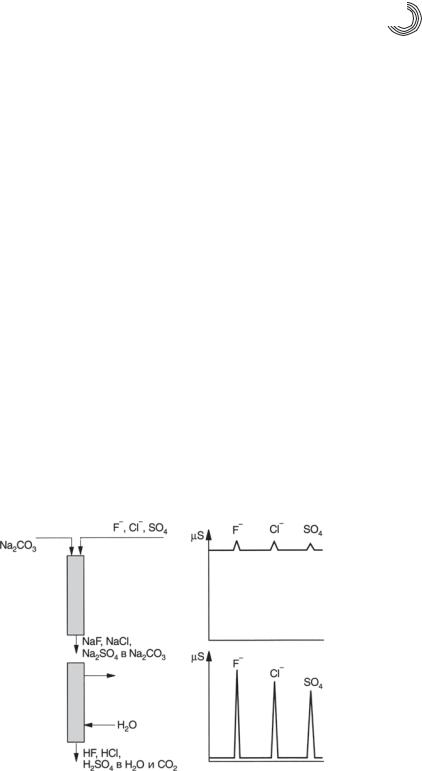
Химическое подавление или, точнее, «ионная хроматография с химическим по& давлением проводимости элюентов в сочетании с кондуктометрическим детекто& ром», означает, что перед поступлением в детектор по проводимости элюент, обла& дающей высокой ионной силой, превращается в слабопроводящую среду, напри& мер, воду. Тем самым подавляется проводимость элюента. Это позволяет проводить высокочувствительное определение крайне низких концентраций ионов в области ppb&концентраций, принцип химического подавления представлен на рис. 6.2.
Существуют различные методы химического подавления, которые со време& нем все больше улучшались и усовершенствовались. Табл. 6.2 показывает различ& ные разработки фирмы Dionex. С новым, поступившим в продажу модулем по& давления от фирмы Metrohm можно в 3–5 раз улучшать пределы определения ионов по сравнению с техникой без химического подавления. Этот модуль состоит из трех подавительных колонок, которые поочередно применяются для подавления,
Проба
Элюент
Аналитическая
колонка
Сброс
Блок подавления
Рис. 6.2. Сравнение хроматограмм разделения ионов с подавительной колонкой и без нее

326
 Глава 6. Ионная хроматография
Глава 6. Ионная хроматография
Таблица 6.2. Историческое развитие методов химического подавления
Ãîä |
Коммерческая реализация |
1975 |
Двухколоночная система |
1981 |
Подавитель на основе мембран из пустотелого волокна |
1985 |
Микромембранный подавитель |
1992 |
Электрохимический подавитель |
|
|
регенерируются и промываются. При этом переключение отдельных колонок про& исходит либо автоматически вместе с переключением крана ввода пробы, либо вручную. Каждая колонка обладает достаточно высокой емкостью. Но чтобы, тем не менее, получать каждую хроматограмму в сопоставимых условиях, рекомендо& вана работа со свежерегенерированной подавительной колонкой [6.10].
Химическое подавление значительно улучшает соотношение сигнал/шум, благодаря следующим факторам:
•сокращению фоновой проводимости электролита,
•повышению проводимости анализируемых компонентов и
•удалению противоионов.
6.2.2.1. Двухколоночные системы
Уже Смолл, Стивенс и Бауман, предложившие ионную хроматографию, работали с химическим подавлением, чтобы улучшать пределы обнаружения ионов. В перво& начальном варианте ИХ, который затем, с внедрением в 1975 метода ИС, стал дос& тупен коммерчески, была использована подавительная колонка. К детектору в этом случае была подключена вторая ионообменная колонка, так называемая подавля& ющая колонка; устройство такой двухколоночной системы показано на рис. 6.3.
Элюент
Насос Инжектор Инжектор
Разделительная колонка |
Реакция обмена |
Детектор |
Реакция подавления |
|
|
|
Ячейка измерения электропроводности |
Рис. 6.3. Схематическое представление двухколоночной ионной хроматографии

6.2. Ионообменная хроматография 327
Задачей подавляющей колонки является, с одной стороны, химическое подавле& ние высокой фоновой проводимости элюента и, с другой стороны, перевод ана& лизируемой пробы в сильнопроводящую форму. Этот вид детектирования также обозначают как «подавленная проводимость».
Так как в ионной хроматографии нужно делать принципиальное различие между анализом анионов и анализом катионов, то процессы, которые протекают при химическом подавлении, следует рассмотреть отдельно для каждого из ана& лизов. Решающим для химического подавления является выбор элюента, т.е. вид добавляемых ионов.
АНИОННАЯ ХРОМАТОГРАФИЯ
В анализе анионов для химического подавления используется тот факт, что для углекислоты только соль существует в ионной форме, в то время как свободная углекислота существует только в виде двуокиси углерода, растворенной в воде. Элюентам готовят на основе карбонат и/или гидрокарбонат. На аналитической разделительной колонке, содержащей анионообменную смолу в карбонатной форме, в соответствии с ее селективностью разделяются анионы из пробы. Элюи& рующая сила элюента, содержащего карбонат/гидрокарбонат, определяется со& отношением обоих анионов и может варьироваться в широкой области.
После разделения в аналитической колонке создающий электропроводность раствора карбонат или гидрокарбонат превращается в подавляющей колонке в сво& бодную кислоту, т.е. в СО2. Одновременно все другие анионы пробы также перехо& дят в форму свободных кислот. Функция подавляющей колонки пояснена на при& мере разделения таких двух анионов, как хлорид и бромид. После разделения обоих анионов на аналитической анионообменной колонке элюент поступает во вторую колонку, которая содержит сильнокислотный катионообменный сорбент в прото& нированной форме (Н&форма). В этой колонке протекают следующие реакции:
1.Создающий высокую электропроводность гидрокарбонат натрия перево& дится за счет обмена натриевых ионов на протон катионообменника в не& диссоциированную углекислоту. Этот процесс обозначают как подавление проводимости элюента.
Смола&SO3– – H+ + NaHCO3 → смола&SO3– – Na+ + H2O + CO2.
2. Хлорид натрия и бромид натрия переводятся в соответствующие им кислоты.
Смола&SO3– – H+ + NaCl → смола&SO3– – Na+ + HCl. Смола&SO3– – H+ + NaBr → смола&SO3– – Na+ + HBr.
Результат реакции подавления: обладающие высокой проводимостью мине& ральные кислоты (Н+&ионы обладают самой большой ионной подвижностью) попадают в детектор по электропроводности в присутствии только слабой прово& дящей угольной кислоты и могут быть обнаружены с высокой чувствительнос& тью. Эквивалентная проводимость для Н+ = 349,8, а для Na+ = 50,1. По закону Кольрауша измеряемая проводимость – это сумма обеих эквивалентных прово& димостей аниона и катиона. Превращение компонентов пробы в соответствую&

328
 Глава 6. Ионная хроматография
Глава 6. Ионная хроматография
щие минеральные кислоты означает дополнительное повышение чувствительно& сти при кондуктометрической детектировании.
КАТИОННАЯ ХРОМАТОГРАФИЯ
По аналогии с анализом анионов реакция подавления для катионов происходит c HCl в качестве элюента. В этом случае подавительная колонка содержит сильно& основный анионообменник в ОН&форме, так что катионы пробы превращаются в гидроксиды, а элюент будет содержать лишь не обладающую проводимостью воду.
Стационарная фаза представляет собой сульфированную по поверхности ионо& обменную смолу. В качестве элюентов используют, как правило, разбавленную со& ляную кислоту в концентрациях около 1 ммоль/л, так как хлорид ионы обменива& ются при последующем подавлении на ОН&ионы и образующаяся при этом вода практически лишена проводимости. На катионообменном сорбенте, находящемся благодаря используемому элюенту в Н&форме, другие катионы разделяются в соот& ветствии с его селективностью. При этом, благодаря появлению ОН&ионов, снова достигают выигрыша в чувствительности, так как они обладают более высокой эк& вивалентной проводимостью, чем другие анионы, хотя увеличение чувствительно& сти и не столь высоко, как при появлении Н+&ионов при анализе анионов.
В этих условиях элюируются ионы щелочных металлов, аммония и простых алкиламинов. Двухзарядные катионы (кальций, магний и переходные металлы) могут не элюироваться разбавленной соляной кислотой, так как обладают крайне высоким сродством к стационарной фазе.
Для разделения щелочноземельных металлов сегодня рекомендуется исполь& зовать в качестве элюента раствор м&фенилендиамин дигидрохлорида. Однако он не может храниться очень долго, так как распадается под действием света.
Переходные металлы (железо, медь, никель, цинк, кобальт и свинец) не могут определяться этим способом, хотя их сродство к стационарной фазе сравнимо со сродством кальция и магния. Причина здесь состоит в нерастворимости гидро& ксидов переходных металлов.
6.2.2.2. Подавитель с мембраной из пустотелого волокна
Система из двух колонок улучшает чувствительность измерения. Тем не менее, она приводит к появлению новых проблем. Как следует из приведенных выше процес& сов ионного обмена, подавительные колонки должны периодически регенериро& ваться. При анализе анионов колонку с катионитом переводят снова в Н&форму промывкой серной кислотой. Наоборот, подавляющая колонка при анализе ка& тионов регенерируется щелочью. Этот процесс поддается автоматизации, и при работе с двумя подавительными колонками возможен также непрерывный ана& лиз, однако стоимость оборудования соответственно увеличивается.
Простая по сути измерительная система становится более сложной и, вместе с тем, более дорогой; из&за подавительной колонки в хроматографической систе& ме возникает дополнительный мертвый объем, что приводит к уширению пиков всех компонентов. Кроме того, из&за изменения во времени удерживания и от& клика детектора при возрастающей нагрузке на подавительную колонку требует& ся регулярная калибровка системы.

6.2. Ионообменная хроматография 329
Этот недостаток удалось устранить с развитием подавителя с мембраной из пустотелого волокна (фирма Dionex), который позволяют работу в непрерывном режиме. Подавительное устройство для анионов содержит катионообменную мем& брану в форме длинной тонкой трубки. Элюент проходит внутри трубки, а ис& пользуемая в качестве регенерирующего раствора разбавленная серная кислота протекает по принципу противотока с внешней стороны мембраны. Во избежа& ние обратного перемешивания полая трубка (мембрана) заполняется инертными стеклянными шариками.
Этот подавитель не требует периодической регенерации и, таким образом, не нужно никакой дополнительной системы насосов. Сосуд с регенерирующим ра& створом устанавливается поверх хроматографа, и раствор подается через регене& ративную ячейку только под действием гидростатического давления.
Так как подавитель анионов содержит из катионообменную мембрану, то ка& тионы элюента обмениваются на присутствующие в регенерирующем растворе протоны. Принцип действия пористой мембраны представлен на рис. 6.4. Дви& жущей силой диффузии протонов через мембрану, в целом, является превраще& ние бикарбоната к угольную кислоту. Для сохранения ионного равновесия катио& ны диффундируют в регенерирующий раствор, чем и поддерживают действие по& давителя [6.11].
Поскольку мертвый объем подавителя с мембраной из полого волокна, за счет заполнения внутреннего объема стеклянными шариками, невелик, то это приво& дит к уменьшению эффектов смешивания разделенных зон и уширения пиков и повышает чувствительность детекторования. Так же устроен и катионный пода& витель с мембраной из полого волокна.
Емкость химического подавления у мембран из полого волокна ограничена, поэтому они применяются только в изократическом режиме и с элюентами низ& кой концентрации. Для улучшения ионного обмена были разработаны микромем& бранный подавители. Они содержат плоские ионообменные мембраны, чтобы увеличить площадь, на которой происходит ионный обмен, и при этом не увели& чивать очень небольшой мертвый объем подавителя. Преимущество состоит в том, что с этим подавителем детектор по электропроводности может использоваться и при градиентном элюировании. В ионной хроматографии в этом случае приме&
Детектор по электропроводности
Элюент
Слив
Слив |
Раствор реагента |
Рис. 6.4. Подавитель на основе полого волокна
