
Бёккер_Хроматография [2009]
.pdf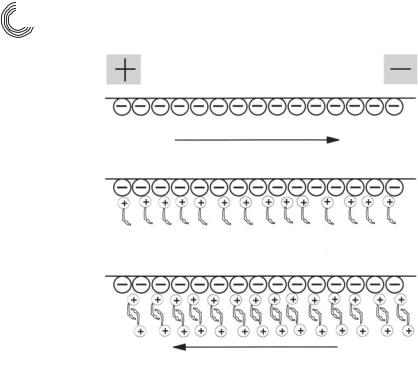
370
 Глава 7. Капиллярный электрофорез
Глава 7. Капиллярный электрофорез
ЭОП
Нет потока
ЭОП
Рис. 7.9. Устранение и обращение направления ЭОП с помощью катионных ПАВ
Возможность изменять селективность разделения состоит в добавлении орга& нических растворителей к водной буферной системе. При добавлении 20% мета& нола последовательность миграции нитрата и сульфата обращается, несколько других ионов также подвергаются влиянию, причем эффект в первую очередь за& висит от доли органического растворителя и затем от вида растворителя.
Хромат с 30% тетрагидрофурана дает в итоге следующую последовательность миграции:
Br– < Cl– <S2O32– <NO2– <NO3– < J– <ClO3– <SO42– < SCN– < F–.
Существенное влияние на селективность разделения имеет, кроме того, ЭОП модификатор. Такая гидрофобная соль четвертичного аммонийного основания может действовать в качестве ион&парного реагента, в частности, для таких боль& ших ионов, как иодид, тиоцианат или тиосульфат. Поэтому эти ионы при повы& шении концентрации модификатора или при использовании модификаторов с большей гидрофобностью избирательно сдвигаются в сторону больших времен миграции.
Разделения неорганических катионов могут проводиться, естественно, без до& бавления ЭОП модификаторов. В этом случае косвенная УФ детекция – это так& же наиболее распространенный вид детектирования, причем рабочими электро& литами служат ароматические амины в протонированной форме, как обладаю& щие поглощением в ультрафиолетовом свете. Разделения часто трудно осуще& ствить, так как многие неорганические катионы обладают очень близкой электро& форетической подвижностью. Селективность разделени можно оптимизировать

7.3. Различные методы разделения 371
добавлением к рабочему электролиту комплексообразователей, от слабых до уме& ренно сильных, которые изменяют эффективный заряд ионов.
С другой стороны, селективность разделения зависит также от вида использу& емого электролита в рабочем буфере и, как и в случае анионов, присутствия в нем органических растворителей. Применение 5 мМ раствора CuSO4 вместо аромати& ческих аминов делает возможным разделение релевантных для клинических ис& следований щелочных и щелочноземельных ионов в биологических жидкостях. Отделение белков перед анализом пробы не требуется.
Более селективное детектирование некоторых ионов металлов с совершенно иной селективностью возможно при их переводе в координационные соедине& ния с помощью комплексообразования с сильными комплексообразующими ре& агентами перед вводом в колонку и прямым УФ детектированием, при использо& вании УФ неактивного рабочего электролита. Подходящие комплексообразую& щие реагенты – это, к примеру, 8&гидроксихинолин&5&сульфокислота или циа& ниды. Такие разделения представляют интерес также для ряда промышленных процессов, при которых нужно анализировать металцианокомплексы.
7.3.2. Мицеллярная электрокинетическая хроматография
Мицеллярная электрокинетическая хроматография (МЭКХ) – это особый слу& чай капиллярного электрофореза, который был введен в 1984 году С. Терабе [7.15]. Так как при КЗЭ механизм разделения основывается на разной подвижности ионов в электрическом поле, то применение этого метода ограничено заряженными ча& стицами. MЭКХ – это гибрид электрофореза и хроматографии [7.16], который может проводиться при использовании нормальной аппаратуры для КЭ с добав& лением ПАВ к электролиту.
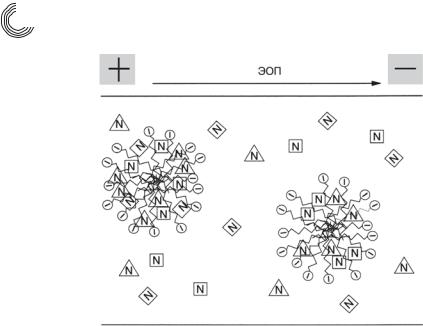
Это единственная техника для разделения как нейтральных молекул, так и заряженных частиц. При этом разделение нейтральных молекул достигается за счет добавления ПАВ к электролиту. При концентрации выше так называемой критической концентрации мицеллообразования ККМ, ПАВ образуют большие агломераты – мицеллы. Гидрофобные цепи ПАВ направлены внутрь мицелл, гид& рофильные, электрически заряженные концы – наружу, т.е. в направлении гид& рофильного буфера, как это показано на рис. 7.10.
Рис. 7.10. Схематическое изображение мицелл катионных и анионных ПАВ
372
 Глава 7. Капиллярный электрофорез
Глава 7. Капиллярный электрофорез
Рис. 7.11. Разделение в МЭКХ
ПАВ и поэтому также мицеллы обычно несут заряд и мигрируют, таким обра& зом, в зависимости от заряда вместе или против ЭОП. Анионные ПАВ мигрируют к аноду, т.е. против ЭОП. Так как, однако, ЭОП в основном быстрее, чем скорость миграции мицелл, то результирующее перемещение осуществляется в направле& нии ЭОП. Во время миграции мицеллы могут реагировать с компонентами ра& створа как за счет гидрофобных, так и за счет электростатических взаимодей& ствий.
Для нейтральной частицы разделения достигают только за счет проникнове& ния и пребывания частиц в мицелле. Чем сильнее компоненты пробы взаимодей& ствуют с мицеллой, тем больше время их миграции, так как анионная мицелла движется против ЭОП. Если вещество не взаимодействует с мицеллой, оно про& сто движется с ЭОП. Более гидрофобные вещества сильнее взаимодействуют с мицеллой и удерживаются поэтому дольше, как это показано на рис. 7.11.
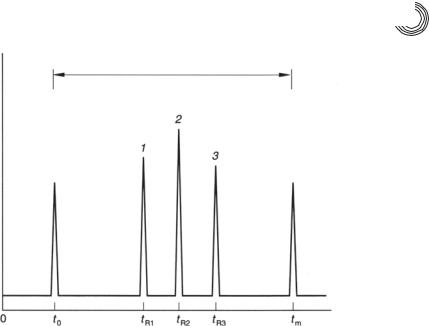
Наблюдаемое разделение имеет определенное сходство с эксклюзионной хро& матографией. При разделении с помощью МЭКХ все нейтральные компоненты элюируются между временем t0, т.е. временем удерживания компонентов, движу& щихся со скоростью ЭОП, и tм, времени удерживания мицеллы (рис. 7.12).
Гидрофильные вещества, которые не взаимодействуют с мицеллами, элюиру& ются со скоростью ЭОП, а вещества, которые постоянно удерживаются в мицел& лах, элюируются вместе с мицеллами. Это, например, наблюдается у полицикли& ческих ароматических углеводородов (ПАУ), которые практически полностью находятся в мицеллах и элюируются вместе с ними.
Несмотря на то что временное окно t0 – tм часто довольно мало, пиковая ем& кость, обусловленная высокой эффективностью, часто очень высока. Тем не ме& нее всегда желательно увеличить временное окно изменением условий проведе& ния анализов. Селективность можно изменять в широких пределах, варьируя фи&
7.3. Различные методы разделения 373
Временное окно
Вещества
ЭОП |
Мицелла |
Рис. 7.12. Временное окно элюирования нейтральных соединений в МЭКХ
зическую структуру мицелл, т.е. их величину, заряд и геометрию, и используя раз& личные типы ПАВ. Это примерно соответствует изменению стационарной фазы в ВЭЖХ.
Как и в хроматографии, для оптимизации условий разделения можно ис& пользовать органические модификаторы, такие как метанол или ацетонитрил, причем нужно обращать внимание на то, что органические растворители могут отрицательно влиять на стабильность мицелл. Первый ПАВ, использованный как фаза для разделения, был анионным – додецил сульфат натрия, за ним после& довали многочисленные анионные и катионные ПАВ, а также смешанные ми& целлы, что позволяет оптимизировать селективность разделения для конкретной задачи.
Псевдостационарные фазы из резоркаренов и суспензий хроматографических частиц представляют новые и перспективные разделяющие фазы для MЭКХ [7.17].
Резоркарены – это циклические тетрамеры, которые получаются из резорци& на и различных альдегидов, причем эти заместители могут подбираться в соответ& ствии с проблемой разделения. Высокая плотность отрицательного заряда у ре& зоркаренов обуславливает их высокую электрофоретическую подвижность, а также хорошую растворимость в электролитных растворах, в том числе и при использо& вании органических растворителей.
При использовании в качестве разделяющих фаз хроматографических частиц вся палитра материалов для ВЭЖХ находится в распоряжении исследователя. Частицы, которые не обладают собственной подвижностью в электрическом поле, переводятся модификацией поверхности в заряженные частицы. Например, ми& целлы додецилсульфата натрия сорбируются на поверхности обращеннофазовых материалов и образуют электрически заряженную частицу. Изменяя количество частиц, можно управлять емкостью разделительной системы.
374
 Глава 7. Капиллярный электрофорез
Глава 7. Капиллярный электрофорез
Время, мин
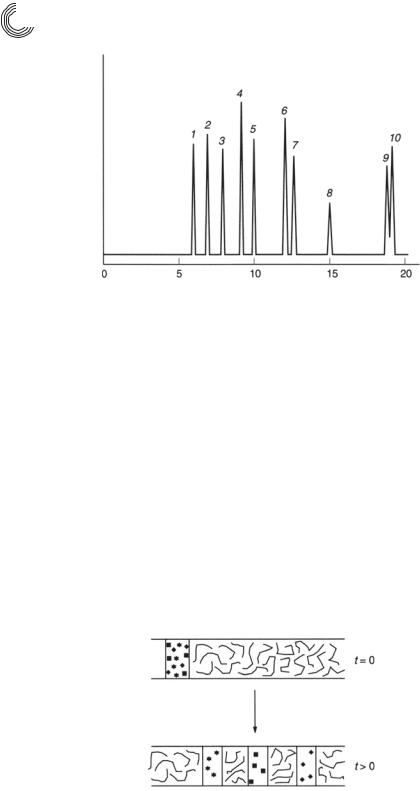
Рис. 7.13. Анализ МЭКХ различных лекарств
Область применения МЭКХ очень велика, так как могут разделяться очень разные вещества от гидрофильных до гидрофобных. Рис. 7.13 показывает анализ некоторых лекарственных соединений.
7.3.3. Капиллярный гельэлектрофорез
Гельэлектрофорез (КГЭ) принципиально был предложен для определения моле& кулярного веса биологических макромолекул, таких как белки и нуклеиновые кислоты. Разделение происходит электрофоретически в подходящем полимере, как, например, поперечносшитый полиакриламид, агароза или же линейный по& лимер [7.18]. Как очевидно из рис. 7.14, полимер действует как молекулярное сито. Заряженные макромолекулы мигрируют сквозь полимерную сетку и тормозятся трением о нее, причем большие молекулы задерживаются сильнее, чем малые.
Макромолекулы, такие как ДНК (дезоксирибонуклеиновая кислота), не мо& гут быть разделены без использования геля, так как соотношение их массы к за& ряду не зависит от величины молекулы. Это означает, что в случае ДНК каждое последующее присоединение нуклеотида к цепи ДНК увеличивает соответствен&
Рис. 7.14. Разделение молекул по размеру при КГЭ

7.3. Различные методы разделения 375
но массу и заряд и, следовательно, не изменяют вследствие этого подвижность молекулы в свободном растворе.
Разделение белков из тканей или клеточных культур может применяться для сравнительного исследования ткани больного и здоровой ткани, чтобы найти в измененных белках причину заболевания [7.19]. КГЭ сравним непосредственно с электрофорезом в пластинках геля, но обладает, однако, тем преимуществом, что сила поля может быть выше в 10–100 раз без заметного выделения тепла.
7.3.4. Капиллярная изоэлектрофокусировка
КИЭФ – это электрофоретическая техника высокого разрешения для разделения пептидов и белков на основе их изоэлектрической точки, которая была разрабо& тана шведским исследователем Х. Свенсоном. Градиент pH формируется внутри капилляра амфолитами. Амфолиты – это молекулы, которые обладают как ос& новными, так и кислотными свойствами, т.е. это цвиттерионны, которые могут, например, принимать значения pH от 3 до 9. После наполнения капилляра сме& сью пробы и амфолитов в капилляре формируется градиент с щелочным раство& ром у катода и кислым раствором у анода, как это показано на рис. 7.15.
При наложении электрического поля заряженные амфолиты и белки мигри& руют в капилляре до тех пор, пока не достигнут зоны с величиной pH, где они становятся электронейтральными, т.е. в изоэлектрической точке. Зоны пробы остаются четко очерченными, так как молекула, которая покидает такую зону, снова заряжается и соответственно возвращается обратно. Процесс «фокусиро& вания» характеризуется протеканием электрического тока через капилляр, тогда как затем, после установления состоянии равновесия, никакой ток больше не те& чет. После фокусировки раствор выдавливается из капилляра под давлением и поступает в детектор [7.20].
Так как пробу вносят в капилляр в смеси с амфолитами, можно вводить суще& ственно более высокие объемы пробы по сравнению с другими методами ВЭКЭ. Единственный лимитирующий фактор – это выпадение различных веществ в оса& док при превышении их растворимости. КИЭФ можно успешно применять для всех проб, которые обычно трудно анализировать другими методами, таких как
Рис. 7.15. Принцип изоэлектрической фокусировки в капилляре

376
 Глава 7. Капиллярный электрофорез
Глава 7. Капиллярный электрофорез
гемоглобин и другие биологические пробы. Возможно масштабирование до пре& паративного формата, причем самым важным фактором является выделение джо& улева тепла, так как при нагревании раствора сфокусированные зоны расплыва& ются из&за диффузии. С помощью специальных поперечно расположенных к на& правлению тока охлаждающих капилляров объем камеры может повышен до бо& лее чем 100 л [7.21].
7.3.5. Капиллярный изотахофорез
При изотахофорезе (КИТФ, электрофорез с равными скоростями) компоненты пробы разделяются благодаря различию своих электрофоретических подвижнос& тей. В этом методе отдельные фракции мигрируют в порядке убывания электро& форетической подвижности, но, в отличие от других методов электрофореза, с одинаковыми скоростями.
Капиллярный изотахофорез – это электрокинетический метод разделения с «мигрирующими границами». При этом разделения ионов в электрическом поле достигают благодаря их специфической подвижности. Благодаря комбинации двух буферных систем разделенные фракции мигрируют с одинаковой скоростью. Зоны находятся подобно сэндвичу между ведущим (фронтальным) и замыкающим элек& тролитами. Подвижность ионов зависит от внутреннего радиуса и заряда, а также от вязкости буфера. Так как подвижность ионов дополнительно зависит от степе& ни диссоциации, ее можно варьировать, изменяя величину pH буфера. Методом ИТФ можно определять либо катионы, либо анионы. Он удобен при анализе орга& нических кислот и оснований, например, аминокислот, пептидов, нуклеотидов, нуклеозидов, биополимеров, синтетических полимеров, а также неорганических солей.
В противоположность капиллярному зонному электрофорезу здесь использу& ется ограниченная система электролитов. Например, для анализа анионов буфер следует выбирать таким образом, чтобы ведущий электролит содержал анион с эффективной подвижностью, превышающей подвижность пробы. Наоборот, под& вижность замыкающего электролита должна быть меньше подвижности пробы.
Проба остается на границе между ведущим и замыкающим электролитом. При наложении электрического поля анионы начинают мигрировать к аноду. Быстрее всех мигрируют ведущие анионы с наибольшей подвижностью. Ионы с более низ& кой подвижностью вынуждены следовать непосредственно за ионами с более вы& сокой подвижностью, так они попадают в зону с более высокой силой поля и сно& ва ускоряются за счет более высокой силы поля. После установки стационарного режима образуются зоны, которые мигрируют с одинаковой скоростью. Как сле& дует из названия «изотахо», индивидуальные анионы мигрируют при ИТФ в дис& кретных зонах, однако с той же скоростью, которая задана скоростью лидирую& щих анионов (рис. 7.16).
Равномерная скорость в ИТФ поддерживается благодаря тому, что электри& ческое поле в каждой зоне различно. Так как скорость движения иона задана его подвижностью и силой поля, то поле регулируется для поддержания постоянной скорости. Это означает, что самое слабое электрическое поле находится в зоне
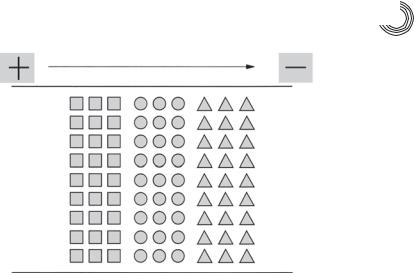
7.3. Различные методы разделения 377
Конечный |
Ведущий |
(замыкающий) |
электролит |
электролит |
|
Рис. 7.16. Принцип капиллярного изотахофореза
ионов с наивысшей подвижностью. Этот феномен обуславливает очень четкие границы между отдельными зонами. Если анион диффундирует в соседнюю зону, его скорость изменяется, и он сразу возвращается обратно.
Следующий интересный аспект ИТФ – это постоянная концентрация в каж& дой зоне, которая определяется концентрацией ведущего электролита. Так как ИТФ проводятся обычно при постоянном токе, должно существовать постоян& ное соотношение между концентрацией и подвижностью ионов в каждой зоне. Зоны, которые сконцентрированы меньше (или сильнее), чем ведущий электро& лит, суживаются (или расширяются), чтобы достичь соответствующей концент& рации.
Этот принцип можно с успехом применять для зонного концентрирования разбавленных проб. Благодаря эффекту концентрирования ИТФ обладает высо& кой чувствительностью при определении в пробе следовых количеств.
Так как концентрация веществ после разделения во всех зонах одинакова, в результате получается нетипичная по сравнению с традиционной хроматографи& ей картина. Ширина зоны компонента прямо пропорциональна его количеству в анализируемой смеси. В результате получают не пики, а ступени. Высота ступе& ней дает в итоге качественную информацию о виде разделенного вещества, в то время как ширина зон пропорциональна количеству вещества, что дает в итоге количественную информацию. Ширину зон можно варьировать, изменяя кон& центрацию ведущих ионов.
Наконец, капилляр можно наполнять пробой примерно на 30–50%, чтобы все еще получать хорошие разделения. Благодаря особому механизму разделения в этом методе не возникает проблем даже при наличии большого избытка неион& ных компонентов в матрице. Изотахофорезу следует отдать предпочтение перед другими электрофоретическими методами, если ионные компоненты нужно оп& ределять в комплексных матрицах. Трудности возникают только при выборе под& ходящего буфера с подходящей подвижностью и величиной pH. Кроме того, в одном эксперименте могут определяться либо только анионы, либо только кати&
378
 Глава 7. Капиллярный электрофорез
Глава 7. Капиллярный электрофорез
оны. Капиллярный изотахофорез используется для разделения неорганических ионов, органических кислот и оснований, нуклеотидов, аминокислот, пептидов, белков, наркотиков или средств защиты растений [7.22].
7.4. Оборудование
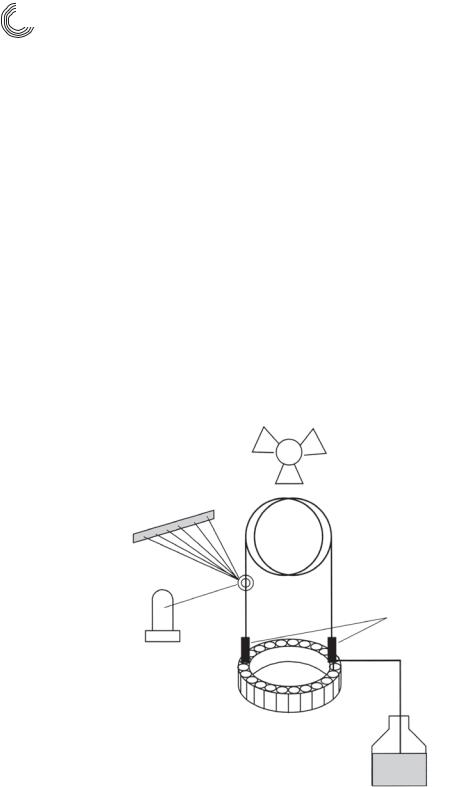
Прибор для капиллярного электрофореза состоит из аналитического устройства с разделительным капилляром, автодозатором и детектором и персонального ком& пьютера, через который задаются все параметры и управляют отдельными процес& сами [7.23]. Принципиальная схема оборудования для ВЭКЭ показана на рис. 7.17.
Анализ происходит в несколько стадий:
1)удаление резервуара с буфером и перемещение конца капилляра в сосуд с пробой,
2)ввод пробы в капилляр либо под давлением, либо под действием электри& ческого поля,
3)устанавка резервуара с новым буфером,
4)подача напряжения для разделения веществ,
5)по прошествии определенного времени разделенные зоны пробы проходят оптическое окно на капилляре, где происходит спектроскопическое детек& тирование.
Термостатирование
Детектор с диодной линейкой
Капилляр
Лампа
Источник
высокого
напряжения
Карусель для проб
Емкость со свежим буфером
Рис. 7.17. Схема прибора для ВЭКЭ
7.4. Оборудование 379
Отдельные рабочие этапы показывают, что для рутинной работы разумно ис& пользовать соответствующим образом автоматизированный прибор. Отдельные составные части для ввода пробы, разделения, детектирования и набора элюен& тов описаны ниже.
7.4.1. Ввод пробы
Условием эффективности анализа является количественный и воспроизводимый ввод пробы. В ВЭКЭ, чтобы достичь высокой эффективности разделения, необ& ходим ничтожно малый объем пробы в области нанолитров. Это, конечно, обус& ловлено малым диаметром используемых капилляров. При этом длина зоны про& бы в капилляре более критична, чем ее объем. Основным правилом является то, что зона пробы не должна превышать 1–2% общей длины капилляра. Отсюда сле& дует, что длина зоны пробы, в зависимости от длины и сечения капилляра, со& ставляет несколько миллиметров, соответственно, от 1 до 50 нл. Это является пре& имуществом метода, если в распоряжении имеется лишь небольшой объем про& бы, так как всего 5 мкл достаточно для многих анализов. К недостаткам следует отнести то, что из&за небольшого количества пробы снижается чувствительность детектора.
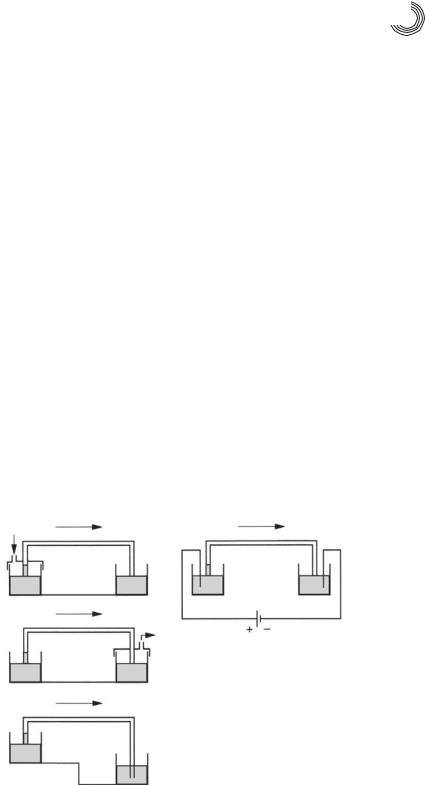
Сегодня используются методы ввода пробы как с помощью электромиграции, так и с помощью градиента давления, сформированного вдоль капилляра, как показано на рис. 7.18. В обоих случаях введенные объемы проб, в общем, не изве& стны, но могут быть вычислены. Вместо объема приводятся рассчитываемые ве& личины давления и времени для гидродинамического ввода или напряжения и времени для электрокинетического ввода.
Гидродинамический ввод |
Электрокинетический ввод |
Давление |
|
Проба |
Проба |
Вакуум
Проба
Проба
Рис. 7.18. Методы ввода пробы
