
- •Оглавление
- •Введение
- •Структура и содержание дисциплины «Биохимия человека»
- •Содержание дисциплины
- •Раздел 2. Важнейшие макромолекулы живого.
- •Раздел 3. Обмен важнейших макромолекул в организме.
- •Раздел 4. Интеграция метаболизма.
- •Тематическое планирование аудиторных занятий дисциплины «Биохимия человека» Тематика и содержание лекционного курса (8 часов)
- •Тематика и содержание лабораторно-практических занятий (лпз) (12 часов)
- •Тема 1. Аминокислоты. Белки. Лабораторно-практическое занятие «Качественные реакции на белки. Реакции осаждения белков»
- •Методические рекомендации к занятию
- •План занятия
- •I.Теоретический практикум Вопросы для контроля знаний:
- •II. Лабораторный практикум
- •Часть 1. Качественные реакции на белки.
- •Часть 2. Реакции осаждения белков
- •Приготовление растворов белков для проведения качественных реакций а) Приготовление неразбавленного белка куриного яйца
- •Б) Приготовление разбавленного раствора куриного альбумина
- •II. Качественные реакции на белки
- •1. Биуретова реакция (обнаружение в молекулах белков пептидных связей)
- •2. Нингидриновая реакция (на обнаружение α-аминокислот)
- •3. Ксантопротеиновая реакция
- •4. Реакция Вуазене
- •5. Реакция Паули
- •Реакция на «слабосвязанную серу»
- •Часть 2. Реакции осаждении белков
- •II. Лабораторный практикум
- •Осаждение белков спиртом
- •Осаждение белков концентрированными минеральными кислотами
- •Осаждение белков органическими кислотами
- •Свертывание белков при нагревании
- •5. Высаливание белков сульфатом аммония
- •Вопросы для самопроверки
- •III. Задачи и упражнения по теме: «Аминокислоты. Белки»
- •Тема 2. Белки. Ферменты. Гормоны. Лабораторно-практическое занятие «Белки – ферменты. Физико-химические свойства ферментов»
- •Методические рекомендации к занятию
- •План занятия
- •I.Теоретический практикум
- •Вопросы для контроля знаний
- •II.Лабораторный практикум
- •Часть 1. Изучение физико-химических свойств ферментов на примере амилазы слюны
- •Часть 2. Исследование химического состава слюны
- •Часть 1. Изучение физико-химических свойств ферментов на примере амилазы слюны
- •1.Влияние температуры на активность ферментов
- •2. Влияние рН среды на активность амилазы слюны
- •3.Специфичность ферментов
- •Влияние активаторов и ингибиторов на активность ферментов
- •Часть 2. Исследование химического состава слюны
- •1. Обнаружение анионов неорганических кислот
- •2. Обнаружение муцина и изучение его природы
- •Вопросы для самопроверки
- •III. Задачи и упражнения по теме: «Белки. Ферменты. Гормоны»
- •Тема 3. Витамины Лабораторно-практическое занятие «Качественные реакции на витамины»
- •План занятия
- •Методические рекомендации к занятию
- •I.Теоретический практикум Вопросы для контроля знаний:
- •Доклады студентов по отдельным витаминам с мультимедийной презентацией по плану:
- •Требования к выступлению с докладом
- •II.Лабораторный практикум
- •Взаимодействие витамина с с краской Тильманса
- •Часть 2. Качественные реакции на водорастворимые витамины
- •Качественные реакции на витамин в1 Витамин в1 (тиамин, анейрин)
- •Диазореакция на витамин в1.
- •Обнаружение витамина в1 в молоке
- •Взаимодействие витамина в1 с гексацианоферратом (III) калия
- •2.Качественные реакции на витамин в2
- •3.Качественные реакции на витамин в6 Витамин в6 (пиридоксин, адермин)
- •Феррихлоридная проба на витамин в6
- •4.Качественные реакции на витамин р Витамин р (рутин, цитрин)
- •5.Качественные реакции на витамин рр Витамин рр (противопеллагрический витамин)
- •Проба с медью на никотиновую кислоту
- •Реакция с карбонатом натрия
- •Часть 3. Качественные реакции на жирорастворимые витамины
- •Качественные реакции на витамин а Витамин а (ретинол, аксерофтол)
- •Проба Друммонда на ретинол
- •Бромхлороформная проба на витамин д
- •Анилиновая проба на витамин д
- •Качественные реакции на витамин е Витамин е (токоферол, антистерильный)
- •Реакция с хлорным железом
- •Реакция с сахарозой
- •Вопросы для самопроверки:
- •III. Задачи и упражнения по теме: «Витамины»
- •Тема 4. Биохимические основы спортивных тренировок Семинар «Биохимия спорта»
- •План занятия
- •I.Доклады студентов по тематике выбранных рефератов.
- •II. Решение задач.
- •Итоговое тестирование по дисциплине «Биохимия человека»
- •Вопросы к экзамену по дисциплине «Биохимии человека»
- •Рекомендуемая литература:
- •Ненасыщенные
- •Моноеновые (СnH2n - 1cooh)
- •Полиеновые
4. Реакция Вуазене
К 2 мл неразбавленного раствора белка в пробирке добавляют одну каплю 2,5%-ного раствора формальдегида. Смешивают и прибавляют 6мл чистой концентрированной соляной кислоты (плотность не менее 1,175), после чего снова перемешивают (можно поставить на водяную баню). Через 10 мин прибавляют при взбалтывании 10 капель 0,5%-ного раствора нитрита натрия. Развивается интенсивное сине-фиолетовое окрашивание. Реакция протекает только с теми белками, которые содержат в своем составе триптофан.
5. Реакция Паули
К 1 мл 1%-ного раствора сульфаниловой кислоты в 5%-ном растворе соляной кислоты приливают 2мл 0,5%-ного раствора нитрита натрия, сильно встряхивают и немедленно добавляют сначала 2мл разбавленного раствора белка, а затем, после перемешивания содержимого пробирки, 6мл 10%-ного раствора карбоната натрия. После смешивания растворов развивается вишнево-красное окрашивание. Возникновение окраски обусловлено наличием в белковой молекуле остатков гистидина и тирозина.
Реакция на «слабосвязанную серу»
В пробирку наливают 0,5—1,0 мл неразбавленного белка, добавляют двойной объем концентрированного раствора щелочи, кладут несколько «кипятильников» и кипятят смесь (осторожно, жидкость может выбросить!). При этом выделяется аммиак, который может быть обнаружен по запаху и по посинению влажной лакмусовой бумажки, поднесенной к отверстию пробирки (не касаться стенки!). Образующийся незначительный осадок растворяется при кипячении. Горячую щелочную жидкость делят на 2 части:
- к первой приливают раствор плюмбита натрия, образуется желто-бурое или черное окрашивание. Плюмбит натрия получается при смешивании растворов растворимых солей свинца (Pb(CH3COO)2 или Pb(NO3)2) с избытком NaOH. Сначала при постепенном прибавлении NaOH выпадает осадок, который при дальнейшем приливании NaOH растворяется.
- ко второй добавляют 2-3 капли свежеприготовленного разбавленного раствора нитропруссида натрия, получается красно-фиолетовое окрашивание.
П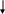 ри
наличии в молекуле белка аминокислот,
содержащих серу (цистина,
цистеина),
от этих аминокислот постепенно отщепляется
также и сера в
виде иона в степени окисления +2. Его
образование можно обнаружить
с помощью ионов тяжелых металлов,
например ионов свинца,
образующих с ионами серы черный
нерастворимый сульфид
свинца: Pb2+
+ S2-
→ PbS
ри
наличии в молекуле белка аминокислот,
содержащих серу (цистина,
цистеина),
от этих аминокислот постепенно отщепляется
также и сера в
виде иона в степени окисления +2. Его
образование можно обнаружить
с помощью ионов тяжелых металлов,
например ионов свинца,
образующих с ионами серы черный
нерастворимый сульфид
свинца: Pb2+
+ S2-
→ PbS
Часть 2. Реакции осаждении белков
Основной теоретический материал
В состав белков входят разнообразные аминокислотные радикалы, поэтому белки вступают во взаимодействие со многими соединениями (кислотами, ионами металлов, спиртами и т. п.), а также конкурируют с ними за молекулы растворителя (воды). Во многих случаях результатом указанных процессов является выпадение белков в осадок.
Реакции осаждения делят на два вида:
Высаливание белков сульфатом аммония (NH4)SO4, при котором снимается только гидратная оболочка, белок сохраняет все виды своей структуры, все связи, сохраняет нативные свойства. Такие белки можно затем вновь растворить и использовать.
В водном растворе белков их частицы заряжены и гидратированы, что обусловливает устойчивость белковых растворов. Но при высокой концентрации солей, ионы которых тоже гидратированы, происходит разрушение водных оболочек белковых молекул и снимается заряд с белковой молекулы адсорбирующимися на ней ионами соли. В результате этих двух процессов белковые растворы теряют устойчивость, частицы белка слипаются друг с другом, укрупняются и, наконец, выпадают в осадок.
Сульфат аммония NH4OH обладает резко выраженной высаливающей способностью и осаждает белки в нейтральной среде, а еще лучше в слабокислой среде. Другие соли, например, хлорид натрия, вызывают полное осаждение бельков только при подкислении раствора белка.
Таким образом, для высаливания различных белков требуется разная концентрация одних и тех же солей. Следовательно, белки можно высаливать фракционно: глобулины выпадают уже при полунасыщении растворов сульфатом аммония, а альбумины выпадают только при полном насыщении.
Осаждение с потерей нативных свойств белка - процесс необратимый. С белка снимается гидратная оболочка и заряд, нарушаются различные свойства в белке. Например, соли меди, ртути, мышьяка, железа, концентрированные неорганические кислоты - HNO3, H2SO4, HCl, органические кислоты, алкалоиды - танины, йодистая ртуть.
Выпадение белков в осадок при нагревании - свертывание - характерно почти для всех белков (исключение составляет желатина, не свертывающаяся при нагревании). Особенно легко и более полно происходит осаждение белка в слабокислой среде, вблизи от изоэлектрической точки (б). В нейтральной и сильнокислой средах (в) осаждение белков идет значительно хуже, а в щелочной среде вовсе не наблюдается (д).
Белки, как амфотерные электролиты, могут диссоциировать как кислоты и как основания. Условно молекулу белка с равным количеством аминных и карбоксильных групп можно изобразить так:

В водной среде, особенно вблизи изоэлектрической точки, молекулы белка представлены в виде нейтрального биполярного иона:

В кислой среде подавляется диссоциация белка по карбоксильным группам, и молекула белка заряжается положительно (белок находится в растворе даже при кипячении, в):

В щелочной среде понижается диссоциация белка по радикалам диаминокислот, и молекулы его приобретают отрицательный заряд, вследствие чего остаются в растворе даже при нагревании до кипения (д):

Добавление к раствору белка нейтральных солей (хлорида натрия, сульфата аммония) облегчает и ускоряет свертывание белков при кипячении (г) вследствие наступающего дегидратирования белковых частиц. Но есть вещества, стабилизирующие белки, - полисахариды, сахара, альдегиды и др.
