
ОХТ в вопросах и ответах Ч2
.pdf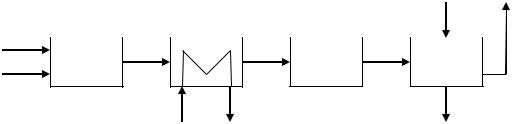
Ответ. Операционная модель представляет перечень основных стадий
(операций) переработки аммиачно-воздушной смеси в азотную кисло-
ту, в том числе, обеспечивающих протекание основных превращений,
таких как:
-подготовка аммиачно-воздушной смеси (АВС);
-окисление аммиака кислородом воздуха;
-окисление оксида азота до диоксида азота;
-охлаждение нитрозных газов;
-переработка оксидов азота в азотную кислоту;
-очистка отходящих газов от оксидов азота.
Вопрос. Из каких подсистем состоит функциональная схема производ-
ства азотной кислоты?
Ответ. Функциональная схема производства азотной кислоты включает в себя подсистемы подготовки АВС, окисления аммиака и утилизации тепла экзотермических реакции, охлаждения нитрозных газов, окисления монооксида азота в диоксид азота, абсорбции образующихся оксидов азота водой и очистки отходящих газов (рис. 4.1). На рис. 4.1 подсистема очистки отходящих газов не показана.
|
|
|
|
|
|
|
|
Отходящие |
|
|
|
|
|
|
|
|
газы |
Воздух |
2 |
|
3 |
|
4 |
|||
|
|
|
||||||
1 |
|
|
|
|||||
Аммиак
НNO3
Рис. 4.1. Функциональная схема производства азотной кислоты:
1 – подсистема подготовки АВС; 2 – подсистема окисления аммиака и утилизации тепла реакции; 3 – подсистема окисления оксида азота и охлаждения нитрозных газов;
4 – подсистема абсорбции диоксида азота
Вопрос. Каковы физико-химические основы процесса окисления аммиа-
ка?
41
Ответ. Реакция окисления аммиака относится к классу сложных, экзотер-
мических, каталитических реакций. При окислении аммиака в зависимо-
сти от условий ведения процесса можно получить оксид азота (ІІ), элемен-
тарный азот и оксид азота (І):
4NH3 |
+ 5O2 |
= 4NO + 6H2O + 904 кДж |
(4) |
4NH3 |
+ 3O2 |
= 2N2 + 6H2O + 1269 кДж |
(5) |
4NH3 |
+ 4O2 |
= 2N2O + 6H2O + 1105 кДж |
(6) |
Схема превращения аммиака включает четыре химические реак-
ции, кроме (4), (5) в неё входят также следующие побочные реакции:
4NH3 + 6NO = 5N2 + 6H2O |
(7) |
2NO = N2 + O2 |
(8) |
так как при температуре процесса 1100–1200 К практически не образуется
NO по реакции (6).
NO
4
7 8
NH3
5
N2
Расчёты этих реакций показывают, что наибольшую термодинами-
ческую вероятность имеет реакция (5), характеризующаяся наибольшим изменением энергии Гиббса (∆G):
Реакция, (номер) |
(4) |
(5) |
(6) |
∆G, кДж/моль при Т= 298 К |
-246,21 |
-326,85 |
-274,75 |
Реакции окисления аммиака (4)–(6) протекают практически необра-
тимо, и поэтому направление процесса определяется соотношением ско-
ростей реакций. В отсутствии катализатора окисление аммиака идёт в ос-
новном с образованием азота по реакции (5). Для производства азотной
42
кислоты необходимо наиболее полное окисление аммиака по реакции (6),
поэтому применяют катализаторы, селективно (избирательно) ускоряю-
щие её. В качестве катализатора используется платина или сплав платины с палладием и родием. Теплоты, выделяющейся в результате реакции, до-
статочно, чтобы процесс протекал автотермично.
Процесс окисления аммиака относится к гетерогенно-
каталитическим процессам. Скорость реакции окисления аммиака при температуре проведения процесса 1073–1273 К значительно выше по сравнению со скоростью диффузионной стадии, вследствие слабой зави-
симости коэффициента диффузии от температуры по сравнению с темпе-
ратурной зависимостью константы скорости реакции. Поэтому скорость процесса лимитирует перенос вещёства и тепла из объёма газового потока к внешней поверхности катализатора, т.е. процесс протекает во внешне-
диффузионной области. В этих условиях нет необходимости применять катализатор с развитой внешней поверхностью, поэтому катализатор представляет собой сетку, сплетённую из металлической проволоки диа-
метром 0,09 мм. Благодаря сетчатой форме создаётся большая внешняя поверхность катализатора.
Вопрос. Как влияет температура и давление на процесс окисления аммиа-
ка?
Ответ. Повышение температуры приводит к увеличению скорости реак-
ции и возрастанию выхода оксида азота NO. При температуре процесса
1123–1193 К выход оксида азота достигает максимального значения.
Дальнейшее повышение температуры приводит к ускорению побочных реакций (7) и (8), имеющих более высокие значения энергии активации,
что приводит к снижению выхода оксида азота. Кроме того, при повыше-
нии температуры увеличиваются потери дорогостоящей платины.
43
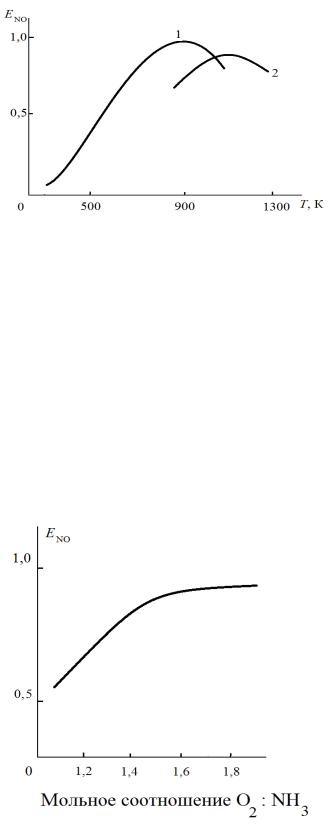
Рис. 4.3. Зависимость выхода оксида азота при окислении аммиака
от температуры:
1 – давление 0,1 МПа; 2 – давление 0,7 МПа
Вопрос. Какое количественное отношение О2:NH3 в аммиачно-
воздушной смеси (АВС) применяют при окислении аммиака?
Ответ. По стехиометрическому уравнению (1) отношение О2 : NH3 со-
ставляет 1,25, что соответствует содержанию аммиака в АВС 14,4 об. %.
При этом отношении выход оксида азота не превышает 60–70 % (рис. 4.4).
Рис. 4.4. Зависимость выхода оксида азота от мольного отношения О2:NH3
44
При увеличении отношения О2 : NH3 выход NO возрастает. Избыток кислорода необходим для того, чтобы поверхность катализатора всегда была покрыта кислородом. При недостатке кислорода окисление аммиака ведёт к образованию N2. Кроме того, аммиачно-воздушная смесь (АВС)
при концентрации аммиака выше 13,8 % (нижний предел взрываемости)
при атмосферном давлении становится взрывоопасной. Поэтому в произ-
водственных условиях содержание аммиака в аммиачно-воздушной смеси поддерживают в пределах 9,5–11,5 об. %, т.е. О2 : NH3 = 1,7–2.
Вопрос. Как зависит выход NO от времени пребывания аммиачно-
воздушной смеси на катализаторе?
Ответ. Скорость каталитического окисления аммиака по реакции (4)
очень высокая. Поэтому за короткое время контакта (порядка 10–4 с) ам-
миак полностью окисляется. При более длительном контакте газа с ката-
лизатором выход NO снижается за счёт протекания побочных реакций: (7)
– взаимодействия полученного оксида азота с аммиаком и (8) – разложе-
ния оксида азота. При времени пребывания меньше, чем 10–4 с наблюдает-
ся уменьшение выхода NO за счёт проскока через катализатор аммиака,
частично превращающегося в азот по реакции (7).
Вопрос. Что представляет собой контактный аппарат окисления аммиака?
Ответ. Контактный аппарат окисления аммиака (реактор) состоит из двух частей: верхней в виде усеченного конуса и нижней цилиндрической ча-
сти (рис. 4.5). Между ними на колосниках расположены катализаторные сетки. Природный газ сжигают в печи 1, а горючие газы из технологиче-
ского процесса – в реакторе-окислителе 2. Затем смесь газов с температу-
рой 1320 К поступает в газовую турбину 3 для привода компрессора и вы-
работки энергии. Далее газы с температурой 1020 К смешиваются с этилбензолом и направляются в реакторы дегидрирования (4 и 6). В теп-
45
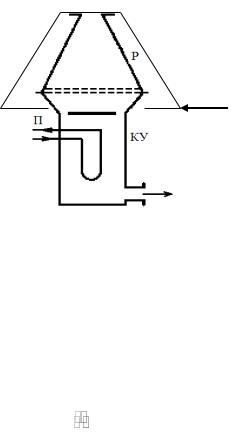
лообменнике 5 производится промежуточный нагрев реакционной смеси
горячими газами.
АВС
Рис. 4.5. Схема реактора окисления аммиака:
Р – реактор; КУ – котёл-утилизатор; АВС – аммиачно-воздушная смесь; П - пар
Вопрос. Что влияет на положение равновесия реакции окисления NO?
Ответ. Реакция окисления NO гомогенная, обратимая, экзотермическая,
протекает с уменьшением объёма:
2NO + O2 2NO2 + Q
Следовательно, в соответствии с принципом Ле Шателье снижение температуры и повышение давления способствуют смещению равновесия реакции вправо. При температуре ниже 400 К эта реакция практически полностью протекает в сторону образования диоксида азота. При более высокой температуре равновесие сдвигается в левую сторону и выше 973
К образование диоксида азота практически не происходит.
Вопрос. Что влияет на увеличение скорости реакции окисления NO?
Ответ. Кинетическая модель реакции отвечает стехиометрическому уравнению реакции окисления оксида азота 2NO + O2 = 2NO2:
r k P |
2 |
P |
|
NO |
|||
1 |
O |
||
|
|
2 |
– k |
P |
2 |
|
NO |
|||
2 |
|
||
|
|
2 |
,
46

где: r – скорость реакции; k1 – константа скорости прямой реакции; k2 – константа скорости обратной реакции.
Скорость реакции окисления NO зависит от концентрации реаген-
тов, давления и температуры. Применение воздуха, обогащённого кисло-
родом, или чистого кислорода позволяет получать нитрозные газы с по-
вышенным содержанием NO2, увеличивая скорость окисления.
Для большинства реакций повышение температуры увеличивает их скорость. Однако для реакции окисления NO в NO2 наблюдается умень-
шение скорости реакции с ростом температуры, а при понижении темпе-
ратуры скорость реакции увеличивается. Это связано с тем то, при окис-
лении идёт образование промежуточного продукта – димера оксида азота:
2NO |
(NO)2 +Q |
(9) |
O2 + (NO)2 2NO2 + Q |
(10) |
|
Образование димера оксида азота – процесс обратимый, экзотерми-
ческий. Повышение температуры вызывает уменьшение равновесной кон-
центрации димера. Скорость дальнейшего окисления димера в диоксид азота зависит от концентрации димера. Таким образом, уменьшение ско-
рости окисления оксида азота в диоксид можно объяснить сильным сни-
жением концентрации димера с повышением температуры.
Давление значительно ускоряет реакцию окисления оксида азота,
увеличивая движущую силу прямой реакции в большей степени, чем об-
ратной. В связи с этим целесообразна организация производства HNO3
при повышенном давлении.
Вопрос. В каком аппарате осуществляется окисление оксида азота?
Ответ. Вследствие не очень высокой скорости реакции окисления оксида азота необходимо увеличить время пребывания реакционной смеси в зоне реакции для её завершения. Поэтому процесс проводят в полом реакторе – окислителе.
47
Вопрос. Каковы физико-химические основы процесса абсорбции диокси-
да азота?
Ответ. Диоксид азота взаимодействует с водой по схеме:
3NO2 + H2O = 2HNO3 + NO + Q (11)
Абсорбция диоксида азота является гетерогенным процессом в си-
стеме газ-жидкость [3, раздел 3.2.2]. По сравнению с диффузией NO2 хи-
мическая реакция (11) протекает быстро вследствие природы реагирую-
щих веществ: «кислота-основание». Образующийся при этом оксид азота
NO частично окисляется в растворе кислородом. В силу плохой раство-
римости в водных растворах азотной кислоты значительная часть NO вы-
деляется в газовую фазу, где окисляется кислородом. Лимитирующей ста-
дией процесса абсорбции является диффузия диоксида азота NO2 в жид-
кую фазу.
Вопрос. Какие параметры процесса влияют на скорость абсорбции (по-
глощения) диоксида азота водными растворами азотной кислоты?
Ответ. Количество абсорбируемого диоксида азота зависит от скорости
W1 первого этапа процесса – переноса NO2 из потока газа через газовый пограничный слой к поверхности раздела фаз [3, раздел 3.2.2]:
|
|
|
|
|
W |
S( p |
|
– p |
|
* |
), |
|
|
|
|
|
|
|
NO |
|
|||||
|
|
|
|
|
1 |
г |
NO |
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где |
pNO |
, |
pNO |
* |
– парциальное давление NO2 в газовой фазе и равно- |
|||||||
|
||||||||||||
|
|
2 |
|
2 |
|
|
|
|
|
|
|
|
весное давление NO2 над водным раствором азотной кислоты соответ-
ственно, βг – коэффициент массоотдачи в газовой фазе.
Из уравнения следует, что скорость поглощения диоксида азота водными растворами азотной кислоты определяется температурой, давле-
нием и концентрацией кислоты. С повышением температуры pNO2* увели-
чивается, а движущая сила этапа переноса ( pNO2 – pNO2* ) уменьшается,
48
что снижает скорость поглощения (абсорбции) NO2 и соответственно уменьшает концентрацию получаемой азотной кислоты. При понижении
температуры и увеличении общего давления понижается |
pNO |
* |
, следова- |
||||||
2 |
|||||||||
|
|
|
|
|
|
|
|
||
тельно, движущая сила процесса абсорбции ( pNO |
|
– pNO |
|
* |
) |
растёт, соот- |
|||
2 |
2 |
|
|||||||
|
|
|
|
|
|
|
|||
ветственно повышается скорость поглощения диоксида азота. |
|
|
|
||||||
По мере протекания абсорбции NO2 концентрация |
|
получаемой |
|||||||
азотной кислоты возрастает, при этом увеличивается давление оксидов
азота над раствором азотной кислоты |
pNO |
* |
, т.е. снижается движущая сила |
|
2 |
||||
|
|
|
процесса массопереноса. Для увеличения движущей силы процесса аб-
сорбции используется противоток жидкой и газовой фаз в аппарате.
Гетерогенный процесс абсорбции NO2 в промышленности проводят при повышенном давлении, так как увеличение давления оказывает по-
ложительное воздействие на абсорбцию диоксида азота. Это позволяет вместо 6–8 абсорбционных колонн, используемых при атмосферном дав-
лении, при повышенном давлении использовать одну колонну, кроме того,
уменьшаются габариты остального оборудования.
Вопрос. Что представляет собой аппарат для абсорбции диоксида азота?
Ответ. Скорость абсорбции (поглощения) оксидов азота зависит от по-
верхности контакта газа с жидкостью, а степень окисления NO в NO2 – от свободного объёма в аппарате. Поэтому основное требование, предъявля-
емое к аппарату – создание максимального свободного объёма и сильно развитой поверхности поглощения. Таким аппаратом является абсорбци-
онная колонна с тарелками (ситчатыми, колпачковыми, переливными и др.). При этом барботаж в слое жидкости обеспечивает интенсивный мас-
сообмен с газом, способствуя поглощению NO2 и тем самым образованию
HNO3, а также жидкофазному окислению NO [3, раздел 3.2.2]. Простран-
ство между тарелками обеспечивает газофазное окисление основного ко-
49
личества выделившегося NO. Кислорода, который подаётся в составе воз-
духа на стадии окисления аммиака, недостаточно для проведения окисле-
ния NO в NO2 в абсорбционной колонне, поэтому недостающий кислород
(воздух) подаётся в абсорбционную колонну для полноты окисления NO.
Для отвода теплоты реакции на тарелках установлены теплообменники с циркулирующей в них водой.
Вопрос. Какие приёмы применены для реализации концепции полного использования сырьевых ресурсов при создании ХТС производства
HNO3?
Ответ. Концепция полного использования сырьевых ресурсов в произ-
водстве HNO3 может быть реализована следующими приёмами:
-избытком одного из реагентов;
-противоточным контактом фаз при абсорбции диоксида азота.
Вопрос. Какие технические и технологические приёмы реализованы или могут быть предложены в производстве азотной кислоты для наиболее полного использования топливно-энергетических ресурсов (ТЭР)?
Ответ. Наиболее полное использование ТЭР в производстве HNO3 мо-
жет быть реализовано следующими приёмами:
-регенерацией тепла в отделении окисления аммиака;
-утилизацией теплоты в отделении окисления аммиака;
-созданием энерготехнологической системы.
Вопрос. Какие технические и технологические приёмы реализованы или могут быть предложены в производстве азотной кислоты для решения концепции минимизации отходов?
Ответ. Минимизация отходов в производстве HNO3 может быть реализо-
вана следующими приёмами:
-очисткой и обезвреживанием газовых выбросов;
-замкнутым водооборотом.
50
