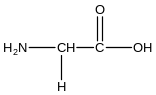
- •Тема 1. Класифікація, номенклатура та ізомерія біоорганічних сполук. Природа хімічного зв'язку. Будова та хімічні властивості альдегідів та кетонів. Актуальність теми
- •Цілі навчання
- •Теоретичні питання
- •Розв'язання типових завдань
- •Набір завдань для контролю самопідготовки
- •Тема 2. Структура, властивості, біологічне значення карбонових кислот та їх функціональних похідних актуальність теми
- •Цілі навчання
- •Теоретичні питання
- •Розв'язання типових завдань
- •Набір завдань для контролю самопідготовки
- •Медико-біологічне значення карбонових кислот та їх похідних
- •Тема 3. Вищі жирні карбонові кислоти. Ліпіди. Фосфоліпіди. Актуальність теми
- •Цілі навчання
- •Теоретичні питання
- •Розв'язання типових завдань
- •Набір завдань для контролю самопідготовки
- •Тема 4. Будова, реакційна здатність та біологічне значення гетерофункціональних сполук (α-, β-, γ-гідроксікислот, кетокислот та фенокислот). Актуальність теми
- •Цілі навчання
- •Теоретичні питання
- •Розв'язання типових завдань
- •Набір завдань для контролю самопідготовки
- •Тема 5. Вуглеводи. Будова та властивості моно-, ді- і полісахаридів актуальність теми
- •Цілі навчання
- •Теоретичні питання
- •Розв'язання типових завдань
- •Набір завдань для контролю самопідготовки
- •Гомополісахариди
- •Тема 6. Класифікація, будова та значення біологічно важливих гетероциклічних сполук актуальність теми
- •Цілі навчання
- •Теоретичні питання
- •Розв'язання типових завдань
- •Набір завдань для контролю самопідготовки
- •Азотисті основи
- •Тема 7. Амінокислотний склад білків і пептидів. Структурна організація білків. Актуальність теми
- •Цілі навчання
- •Теоретичні питання
- •Набір завдань для контролю самопідготовки
- •Лабораторний практикум Альдегіди і кетони Якісні реакції на карбонільну групу
- •Гетерофункціональні сполуки
- •Гетероциклічні сполуки
- •Амінокислоти. Білки
- •Основні правила техніки безпеки:
- •Питання до підсумкового заняття з біоорганічної хімії
- •Рекомендована література
- •Інформаційні ресурси
Набір завдань для контролю самопідготовки
Завдання 1
Структурним компонентом якої амінокислоти є імідазол?
А. Триптофан
В. Тирозин
С. Фенілаланін
D. Гістидин
Е. Пролін
Завдання 2
Назвіть амінокислоту. Який тип радикалів вона містить?
-

А. Глутамінова кислота, негативно заряджені
В. Глутамінова кислота, позитивно заряджені
С. Глутамінова кислота, гідрофобні
D. Глутамін, полярні
Е. Глутамін, негативно заряджені
Завдання 3
Для амінокислот характерне явище оптичної ізомерії. З яких ізомерів складаються клітинні білки?
А. L- амінокислоти
В. D- амінокислоти
С. Цис-ізомери амінокислот
D. Транс-ізомери амінокислот
Е. α-Гідроксикислоти
Завдання 4
Амінокислота L- аргінін використовується як лікарський препарат в медичній практиці. Яке значення рН середовища характерне для його водного розчину?
А. рН<7
В. рН>7
С. рН=7
D. рН=14
Е. рН=0
Завдання 5
Який біогенний амін утворюється при декарбоксилюванні амінокислоти триптофану?
А. Триптамін
В. Серотонін
С. Гістамін
D. Етаноламін
Е. Холін
Завдання 6
Амінокислоти проявляють амфотерні (подвійні) властивості. З якою парою речовин вони реагуватимуть, проявляючи кислотно-основні властивості?
А. Н2О и NаОН
В. Н2О и НСl
С. NаОН и С2Н5ОН
D. NаОН и НСl
Е. НСl и С2Н5ОН
Завдання 7
Вкажіть, для якої амінокислоти не характерне явище оптичної ізомерії :
А. Аланін
В. Гліцин
С. Глутамінова кислота
D. Серин
Е. Аспаргін
Завдання 8
Однією з основних властивостей амінокислот є утворення пептидного зв'язку. Яка його структура?
А. –NН-СО-
В. –СО-NН-
С. –СН-NН-
D. –СН-О-СО-
Е. –NН-СН-
Завдання 9
- Спіраль і β - складчаста структури поліпептидних ланцюгів, що стабілізуються внутрішньомолекулярними водневими зв'язками, представляють:
А. Первинну структуру білку
В. Вторинну структуру білку
С. Третинну структуру білку
D. Четвертинну структуру білку
Е. Біологічний комплекс білку з непротеїновою молекулою
Завдання 10
Просторова організація декількох поліпептидних субодиниць представляє:
А. Первинну структуру білку
В. Вторинну структуру білку
С. Третинну структуру білку
D. Четвертинну структуру білку
Е. Складний протеїн.
Завдання 11
Напишіть структурну формулу, дайте назву дипептиду: Вал – Фен.
Завдання 12
Напишіть ланцюжок перетворень, назвіть продукти А і В:

Еталони відповідей:
1 – D, 2 – A, 3 – A, 4 – B, 5 – A, 6 – D, 7 – B, 8 – В, 9 – B, 10 – D.
Додаток 7.1.
Граф логічної структури
Амінокислоти
як структурні одиниці білкової молекули
Медико-біологічне
та фармацевтичне значення
амінокислот
Хімічні
властивості амінокислот
Якісні
реакції на амінокислоти
Класифікація
та будова
Амфотерні
властивості
Реакції
поліконденсації
Утворення
поліпептидів
Білки
як біополімери
Медико-біологічне
та фармацевтичне значення
пептидів
та білків
Структурна
організація білків.

Додаток 7.2. Будова амінокислот
Гідрофобні амінокислоти |
|||||||
|
|
|
|
||||
Аланін (Алa) рI = 6,0 |
Валін (Вал) (незамінна)рI = 5.96 |
Лейцин (Лей) (незамінна) рI = 5,98 |
Ізолейцин (Іле) (незамінна) рI = 6,02 |
||||
|
|
|
|
||||
Пролин (Про) рI = 6,3 |
Фенилаланин (Фен) (незамінна) рI = 5,48 |
Триптофан (Три) (незамінна) рI = 5,89 |
Метіонін (Мет) (незамінна) рI = 5,74 |
||||
Гідрофільні нейтральні амінокислоти |
|||||||
|
|
|
|
|
|||
Гліцин (Глі) рI = 6.0 |
Серин (Сер) рI = 5.7 |
Треонін (Тре) (незамінна) рI = 5,6 |
Аспаргін (Асн) рI = 5,4 |
Глутамін (Глн) рI = 5,65 |
|||
Гідрофіильні нейтральні амінокислоти |
Гідрофільні аніонні амінокислоти |
||||||
|
|
|
|
||||
Цистеїн (Цис) рI = 5.0 |
Тирозин (Тир) рI = 5.7 |
Аспаргінова кислота (Асп) рI = 3.0 |
Глутамінова кислота (Глу) рI = 3.2 |
||||
Гідрофільні катіонні амінокислоти |
|||||||
|
|
|
|||||
Лізин (Ліз) (незаменимая)рI = 9.8 |
Аргінін (Арг) рI = 10.8 |
Гістидин (Гіс) рI = 7.6 |
|||||