
- •А.В. Космынин, в.С. Виноградов теплотехника
- •Введение
- •1. Основные понятия технической термодинамики
- •1.1. Материя и энергия
- •1.2. Физическое состояние вещества
- •1.3. Масса, сила тяжести и вес
- •1.4. Количество вещества, молярная масса и молярный объем
- •2. Основные параметры состояния
- •2.1. Плотность и удельный объем
- •2.2. Давление. Единицы давления
- •2.3. Избыточное и вакуумметрическое давление
- •2.4. Температура
- •2.6. Задачи для самостоятельного решения
- •3. Законы идеальных газов
- •3.1. Идеальные газы
- •3.2. Законы Бойля-Мариотта, Гей-Люссака и Шарля
- •3.3. Уравнение состояния идеальных газов
- •3.4. Закон Авагадро
- •3.5. Уравнение Менделеева
- •4. Смеси жидкостей, газов и паров
- •4.1. Чистые вещества и смеси
- •4.2. Состав смесей жидкостей, паров и газов
- •4.3. Газовые смеси. Закон Дальтона
- •4.4. Объемные доли газовой смеси
- •4.5. Примеры решения задач Пример 4.1
- •Пример 4.2
- •Пример 4.3.
- •4.6. Задачи для самостоятельного решения
- •5. Теплоемкость
- •5.1. Общие понятия и определения
- •5.2. Теплоемкости изохорная и изобарная
- •5.3. Нахождение истинных и средних теплоёмкостей
- •5.4. Теплоёмкость смесей
- •5.5. Примеры решения задач Пример 5.1
- •Пример 5.2
- •Пример 5.3
- •Пример 5.4
- •Пример 5.5
- •5.6. Задачи для самостоятельного решения
- •6. Первое начало термодинамики
- •6.1. Уравнение первого закона термодинамики
- •6.2. Внутренняя энергия. Закон Джоуля
- •6.4. Теплота. Функция состояния и процесса
- •6.5. Работа изменения давления. Энтальпия
- •7. Второе начало термодинамики
- •7.1. Формулировки второго начала термодинамики
- •7.2. Понятие об энтропии и ts-диаграмме
- •8. Термодинамические процессы газов
- •8.1. Обратимые процессы и их свойства
- •8.2. Основные термодинамические процессы
- •8.3. Изохорный процесс
- •8.4. Изобарный процесс
- •8.5. Изотермический процесс
- •8.6. Адиабатный процесс
- •8.7. Политропный процесс
- •8.8. Примеры решения задач
- •8.9. Задачи для самостоятельного решения
- •9. Термодинамические циклы
- •9.1. Прямые и обратные циклы
- •9.2. Цикл Карно и его термодинамическое значение
- •9.3. Регенеративный цикл
- •9.4. Основные процессы в одноступенчатом компрессоре
- •9.5. Работа и мощность на привод компрессора
- •9.6. Многоступенчатый компрессор
- •9.7. Детандеры
- •9.8. Циклы поршневых двигателей
- •9.9. Идеальные циклы двигателей внутреннего сгорания
- •9.10. Циклы газотурбинных установок
- •9.11. Цикл Стирлинга
- •9.12. Цикл воздушной холодильной машины. Тепловой насос
- •9.13. Примеры решения задач
- •9.14. Задачи для самостоятельного решения
- •10. Теплопередача
- •10.1. Основные положение теории переноса теплоты
- •10.2. Теплопроводность
- •10.3. Конвективный теплообмен
- •10.4. Теплообмен излучением
- •10.5. Закон Стефана-Больцмана
- •10.6. Дифференциальное уравнение энергии трехмерной нестационарной теплопроводности твердых тел
- •10.7. Теплопроводность при стационарном режиме
- •Плоская стенка
- •Цилиндрическая стенка
- •10.8. Теплопередача через твердую стенку
- •10.9. Понятие о теплообменных аппаратах
- •Влияние загрязнения стенки на передачу теплоты
- •10.10. Примеры решения задач Пример 10.1
- •11. Основы химической термодинамики
- •12. Топливо и основы горения
- •12.1. Общие сведения
- •12.2. Элементарный состав топлива
- •12.3. Характеристики топлива
- •12.4. Закон Гесса
- •12.5. Количество топлива, необходимое для горения
- •12.6. Состав и объем продуктов сгорания
- •12.7. Теплосодержание дымовых газов
- •13. Энергетика и пути ее развития
- •14. Энергосбережение
- •15. Проблемы экологической защиты окружающей среды
- •Контрольное задание
- •Варианты исходных данных
- •Вопросы к экзамену
- •Приложения Приложение 1 Удельные газовые постоянные некоторых газов и водяного пара
- •Приложение 2 истинные удельные теплоемкости некоторых газов и водяного пара
- •Приложение 3 Теплопроводность материалов
- •Литература
- •Содержание
- •10. Теплопередача 57
7.2. Понятие об энтропии и ts-диаграмме
Понятие энтропии введем следующим образом. Пусть имеется источник теплоты с постоянной температурой Т и рабочее тело той же температуры Т, к которому от источника обратимо подводится количество теплоты dQ. Необходимо отыскать величину,
которая характеризовала бы изменение состояния рабочего тела. Поскольку изменяются только температура и количество теплоты, причем с повышением Т воздействие dQ на состояние рабочего тела уменьшается, то такой величиной может быть только соотношение:
![]() .
.
Величина S была названа Клазиусом энтропией. Если же в рассматриваемом примере температура источника (Ти) будет выше температуры рабочего тела Т, то переход теплоты обратно от рабочего тела к источнику окажется невозможным, как противоречащий второму началу термодинамики, т.е. мы будем иметь дело с необратимым процессом. Тогда:
![]() ,
,
и общее выражение второго закона термодинамики для обратимых и необратимых процессов будет иметь вид:
![]() .
.
Если же система
(рабочее тело) изолирована в тепловом
отношении, т.е. не получает и не отдает
теплоту (dQ = 0), то
![]() .
Энтропия изолированных систем при
обратимых процессах постоянна, а при
необратимых возрастает, уменьшаться
она не может. Поскольку все реальные
процессы необратимы, второй закон
называют законом возрастания энтропии.
.
Энтропия изолированных систем при
обратимых процессах постоянна, а при
необратимых возрастает, уменьшаться
она не может. Поскольку все реальные
процессы необратимы, второй закон
называют законом возрастания энтропии.
П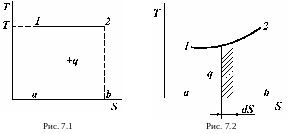 онятие
энтропии позволяет ввести очень удобную
для термодинамических процессов и
циклов диаграмму состояний, в которой
по оси абсцисс откладывают значение
энтропии, а по оси ординат – абсолютную
температуру. В T-S-диаграмме
состояние рабочего тела изображается
точками, термодинамические процессы
линиями, а теплота, участвующая в
процессе, площадью под линией процесса.
онятие
энтропии позволяет ввести очень удобную
для термодинамических процессов и
циклов диаграмму состояний, в которой
по оси абсцисс откладывают значение
энтропии, а по оси ординат – абсолютную
температуру. В T-S-диаграмме
состояние рабочего тела изображается
точками, термодинамические процессы
линиями, а теплота, участвующая в
процессе, площадью под линией процесса.
В процессе при T = const (рис. 7.1) имеем:
![]() или
или ![]() .
.
На диаграмме отрезок 1 – а равен Т, а отрезок а – b разности энтропий (S2 – S1). Тогда произведение этих отрезков, равное площади прямоугольника 1 – 2 – а – b – 1, определяет теплоту процесса 1 – 2.
В процессе с
переменной температурой (рис. 7.2)
теплоту, участвующую в процессе, также
можно изобразить графически под линией
процесса 1 - 2. Если процесс 1 - 2 разбить
на бесконечно большое множество
бесконечно малых отрезков, в пределах
которых Т можно считать неизменной,
то для элементарного количества теплоты
имеем:
![]() .
Для определения всего количества
теплоты, участвующей в процессе 1 - 2,
следует проинтегрировать последнее
уравнение:
.
Для определения всего количества
теплоты, участвующей в процессе 1 - 2,
следует проинтегрировать последнее
уравнение:
![]() .
.
Отметим, что иногда T-S-диаграмму называют тепловой.
8. Термодинамические процессы газов
8.1. Обратимые процессы и их свойства
Изменение состояния рабочего тела, при котором параметры состояния (все или некоторые) изменяются, а масса рабочего тела, совершающего процесс, остается неизменной, называется термодинамическим процессом.
В теплотехнике наибольший интерес представляют процессы, которые протекают в тепловых машинах. Однако термодинамическое исследование таких процессов затруднено из-за ряда явлений, сопровождающих их протекание (образования вихрей в рабочем теле, вызываемых большими скоростями, теплового излучения в атмосферу, трения и др.). Поэтому в термодинамике рассматриваются упрощенные, идеализированные процессы, которые могут быть теоретически исследованы.
Характерной чертой таких упрощенных процессов является их обратимость. Обратимыми называются процессы, после совершения которых в прямом и обратном направлениях, вся система тел, принимавших участие в процессе, возвращается в свое первоначальное состояние.
В обратимом термодинамическом процессе линии прямого и обратного процессов сливаются. При этом работа в прямом и обратном направлениях определяется одной и той же площадью, т.е. она будет одинаковой по абсолютному значению, отличаясь только знаком. Равенство абсолютных значений работ означает и равенство абсолютных значений подводимой и отводимой теплоты.
Все обратимые процессы – равновесны. Выясним, что же понимают под равновесным процессом. Допустим, что в цилиндре сжимается рабочее тело и одновременно подводится теплота. В реальных условиях повышение температуры происходит не одновременно по всей массе рабочего тела, а постепенно от нагревающей поверхности внутрь. Кроме того, слои расположенные у поршня, сжаты больше, и выравнивание давления происходит постепенно от поршня к крышке цилиндра.
Таким образом, в реальных тепловых машинах температура и давление не одинаковы по всей массе рабочего тела. Такое состояние называется неравновесным, а процессы, в которых рабочее тело проходит через неравновесные состояния – неравновесными.
Но, если в пространстве, занимаемом телом, температура и давление не одинаковы, то невозможно изобразить такое состояние точкой, а процесс линией. Поэтому для исследования неравновесных процессов нельзя использовать способ графического изображения и применять уравнения состояния. Чтобы упростить расчеты и исследование, в термодинамику введено понятие обратимых и равновесных процессов, которые позволяют получить результаты с достаточной для практики степенью точности.
