
- •М инистерство образования российской федерации
- •Кафедра органической, физической и коллоидной химии
- •Органическая химия «Карбоновые кислоты»
- •Москва – 2004
- •Содержание
- •Введение ……………………………………………………………… 4
- •Словарь основных понятий по теме «Карбоновые кислоты»……… - Введение
- •1.Предельные монокарбоновые кислоты
- •1.1.Номенклатура
- •1.2.Изомерия
- •1.3.Способы получения
- •1.4. Физические свойства
- •1.5.Электронное строение карбоксильной группы
- •1.6.Химические свойства
- •1.6.1.Кислотные свойства
- •1.6.2.Основные свойства
- •1.6.3.Реакции с участием -водородного атома
- •1.6.4.Получение производных карбоновых кислот
- •2.Непредельные монокарбоновые кислоты
- •3.Высшие карбоновые кислоты
- •4.Дикарбоновые кислоты
- •5.Ароматические карбоновые кислоты
- •6.Отдельные представители карбоновых кислот, их применение в промышленности
- •6.1.Одноосновные насыщенные кислоты
- •6.2.Одноосновные ненасыщенные кислоты
- •6.3.Высшие карбоновые кислоты
- •6.4.Предельные дикарбоновые кислоты
- •6.5.Непредельные дикарбоновые кислоты
- •6.6.Ароматические монокарбоновые кислоты
- •6.7.Ароматические дикарбоновые кислоты
- •Тест по теме «Карбоновые кислоты»
- •Вопросы для самоконтроля по теме«Карбоновые кислоты»
- •Ответы на тестовые задания по теме «Карбоновые кислоты»
- •Список рекомендуемой литературы
- •Словарь основных понятий по теме «Карбоновые кислоты»
- •Для заметок
- •Органическая химия «Карбоновые кислоты»
1.6.Химические свойства
Свойства карбоновых кислот обусловлены в первую очередь присутствием в их молекулах карбоксильной группы.
1.6.1.Кислотные свойства
Карбоновые кислоты в водных растворах диссоциируют:
 R-COOH
+ H2O
R-COO-
+ H3O+
R-COOH
+ H2O
R-COO-
+ H3O+
Однако по сравнению с минеральными кислотами, такими как HCl, HBr, HI, H2SO4, HNO3, H3PO4 и др., органические кислоты намного слабее, но более сильные, чем угольная кислота. Поэтому минеральные кислоты вытесняют карбоновые кислоты из их солей, а карбоновые кислоты в свою очередь вытесняют угольную кислоту из ее солей. Согласно теории кислот и оснований Бренстеда-Лоури, такие соединения, как вода, спирты, ацетилен, аммиак, амины, углеводороды, можно рассматривать также как кислоты. Однако они по сравнению с карбоновыми кислотами намного слабее. Относительная кислотность этих соединений изменяется в таком порядке:
HCl R-COOH H-OH R-OH HCCH NH3 R-H
Так, кислотные свойства атома водорода гидроксильной группы карбоксила карбоновой кислоты за счет (-)I-эффекта и эффекта p,-сопряжения -CO- группы значительно сильнее, чем водорода гидроксила молекулы воды. Вместе с тем, кислотные свойства водорода группы OH спирта, благодаря (+)I-эффекта алкильной группы проявляются слабее, чем у гидроксила воды. Сказанное подтверждается значением КД25 для этих веществ:
O
H3C
C O H H OH H3C
CH2
O H
КД25=1,7610-5
КД25=10-14
КД25=10-18
Кислотные свойства карбоновых кислот (R-COOH) зависят от природы и строения алкильного радикала (-R), присутствия заместителей в его углеродной цепи. Группы R- с положительным электронным эффектом уменьшают величину частичного заряда + на карбонильном C-атоме и тем самым уменьшает его электроноакцепторное действие на группу –OH. Это приводит к уменьшению силы карбоновой кислоты. Поэтому в гомологическом ряду монокарбоновых кислот муравьиная кислота, в молекуле которой рядом с карбоксильной группой нет углеводородного радикала с положительным электронным эффектом, является наиболее сильной. Уксусная кислота в сравнении с муравьиной в десять раз слабее, поскольку в ее молекуле есть метильный радикал, который проявляет (+)I-эффект. Атомы и группы атомов с отрицательным электронным эффектом увеличивают величину заряда + на карбонильном C-атоме и тем самым усиливают электроноакцепторное действие карбонила на группу –OH. Это обусловливает значительное повышение силы карбоновой кислоты. Поэтому хлоруксусная кислота приблизительно в 20 раз сильнее, чем уксусная. Таким образом, группы R- с положительным электронным эффектом уменьшают, а с отрицательным электронным эффектом увеличивают силу карбоновых кислот. Это убедительно подтверждает сравнение значений рКк карбоновых кислот, которые содержат R- разной электронной природы (стрелками показано смещение электронов в молекуле кислоты):
H
COOH H3C
COOH H3C
CH COOH
CH3
рКк=
3,75 рКк=
4,75 рКк=
4,86
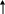
Cl
CH2
COOH Cl CH2
COOH
Cl
рКк=
2,85 рКк=
1,75
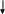
По мере удаления заместителей с (-)I-эффектом от карбоксильной группы его влияние на эту группу уменьшается (затухает). Это видно из сравнения кислотных свойств хлормасляных кислот:
H3C-CH2-CH-COOH
H3C-CH-CH2-COOH
H2C-CH2-CH2-COOH
Cl
Cl
Cl
рКк=
2,86 рКк=
4,05 рКк=
4,42
Как видно из значений рКк этих кислот, наиболее сильное влияние на карбоксильную группу имеет атом галогена тогда, когда он находится ближе всего к этой группе, т.е. в -положении относительно карбоксильной группы. Поэтому -хлормасляная кислота значительно сильнее - и -хлормасляных кислот, а -хлормасляная кислота по этой же причине сильнее -хлормасляной кислоты.
Характерной реакцией карбоновых кислот, которая проходит с участием водорода карбоксильной группы, является реакция образования солей. Соли карбоновых кислот получаются при их взаимодействии с активными металлами, основными оксидами, основаниями, солями угольной кислоты:
2CH3-COOH + Mg --- (CH3-COO)2Mg + H2
2CH3-COOH + CaO --- (CH3-COO)2Ca + H2O
CH3-COOH + KOH --- CH3-COOK + H2O
CH3-COOH + NaHCO3 --- CH3-COONa + H2O + CO2
Соли карбоновых кислот являются кристаллическими, ионно построенными, нелетучими веществами. Аммонийные соли и соли щелочных металлов органических кислот хорошо растворимы в воде, но не растворяются в неполярных растворителях.
