
- •Практическое занятие № 1
- •По графику проекции скорости построить график проекции ускорения и график проекции перемещения тела.
- •Практическое занятие № 2
- •Записать наименование и цель занятия.
- •Ответить на контрольные вопросы и получить допуск к работе.
- •Выполнить задания.
- •Законы Ньютона:
- •Закон всемирного тяготения:
- •Сила упругости
- •III. Трение
- •Практическое занятие № 3
- •Записать наименование и цель занятия.
- •Ответить на контрольные вопросы и получить допуск к работе.
- •Выполнить задания.
- •Практическое занятие № 4
- •Записать наименование и цель занятия.
- •Ответить на контрольные вопросы и получить допуск к работе.
- •Выполнить задания.
- •Практическое занятие № 5
- •Записать наименование и цель занятия.
- •Ответить на контрольные вопросы и получить допуск к работе.
- •Выполнить задания.
- •Практическое занятие № 6
- •Записать наименование и цель занятия.
- •Ответить на контрольные вопросы и получить допуск к работе.
- •Выполнить задания.
- •Практическое занятие № 7
- •Записать наименование и цель занятия.
- •Ответить на контрольные вопросы и получить допуск к работе.
- •Выполнить задания.
- •Практическое занятие № 8
- •Записать наименование и цель занятия.
- •Ответить на контрольные вопросы и получить допуск к работе.
- •Выполнить задания.
- •Законы:
- •Закон сохранения заряда.
- •Закон Кулона.
- •Практическое занятие № 9
- •Записать наименование и цель занятия.
- •Ответить на контрольные вопросы и получить допуск к работе.
- •Выполнить задания.
- •Практическое занятие № 10
- •Записать наименование и цель занятия.
- •Ответить на контрольные вопросы и получить допуск к работе.
- •Выполнить задания.
- •Практическое занятие № 11
- •Записать наименование и цель занятия.
- •Ответить на контрольные вопросы и получить допуск к работе.
- •Выполнить задания.
- •Закон Джоуля—Ленца: Количество теплоты q, выделяемой током I за время t на участке цепи сопротивлением r, равно
- •Плотность тока – характеристика распределения тока в проводнике
- •Практическое занятие № 12
- •Записать наименование и цель занятия.
- •Ответить на контрольные вопросы и получить допуск к работе.
- •Выполнить задания.
- •Практическое занятие № 13
- •Записать наименование и цель занятия.
- •Ответить на контрольные вопросы и получить допуск к работе.
- •Выполнить задания.
- •Практическое занятие № 14
- •Записать наименование и цель занятия.
- •Ответить на контрольные вопросы и получить допуск к работе.
- •Выполнить задания.
- •Построение изображения в плоском зеркале.
- •Практическое занятие № 15
- •Записать наименование и цель занятия.
- •Ответить на контрольные вопросы и получить допуск к работе.
- •Выполнить задания.
- •Типы радиоактивного распада:
Практическое занятие № 6
Наименование занятия: Молекулярно-кинетическая теория (МКТ) идеального газа.
Цель занятия: применение теоретических знаний для решения задач.
Подготовка к занятию: лекция № 7. Касьянов В.А. Физика-10 § 37, 39–44.
В-1
Задание на занятие:
Сколько молекул содержится в углекислом газе (CO2) массой 20 г?
Рассчитайте давление, которое производят молекулы газа на стенки сосуда, если масса газа 3 г, объём 0,5×10-3 м3, а средняя квадратичная скорость молекул 500 м/с.
Какова средняя квадратичная скорость молекул гелия при 27 °C?
В процессе изохорного охлаждения давление газа уменьшилось в 3 раза. Какой была начальная температура газа, если конечная температура стала равной 27 °C?
При давлении 105 Па и температуре 15 °C воздух имеет объем 2 л. При каком давлении воздух данной массы займет объем 4 л, если температура его станет равной 20 °C?
Баллоны электрических ламп заполняют азотом при давлении 52 кПа и температуре 290 К. Каким станет давление в горящей лампе в момент, когда температура газа достигнет 630 К?
 Чему
равно давление углекислого газа на
стенки сосуда, если известно, что его
температура 700 К?
Чему
равно давление углекислого газа на
стенки сосуда, если известно, что его
температура 700 К?На рисунке дан график изменения состояния идеального газа в координатах V – T. Представьте этот процесс на графиках в координатах p – V и p – T.
Оцените диаметр атома углерода, зная значение плотности алмаза, которая равна 3515 кг/ м3.
В-2
Задание на занятие:
Найти число атомов в свинцовом предмете массой 234 г.
Определите, при какой температуре средняя квадратичная скорость молекул кислорода равна 500 м/с.
Сколько молекул содержится в 2 м3 газа при давлении 150 кПа и температуре 27 °C?
В баллоне объемом 200 л находится гелий под давлением 100 кПа при температуре 17 °C. После подкачивания гелия его давление поднялось до 300кПа, а температура увеличилась до 47 °C. На сколько увеличилась масса гелия?
В процессе изобарного охлаждения объем идеального газа уменьшился в 2 раза. Какова конечная температура газа, если его начальная температура равна 819 °C? Масса газа постоянна.
Давление в резиновой покрышке 405,3 кПа при температуре 20 °C. Каким будет давление в этой покрышке, если температуру повысить на 28 °C ?
 Определите
массу кислорода в баллоне, если известно,
что давление, которое он оказывает на
стенки баллона при температуре 40 °C
равно
840 кПа. Число молекул равно постоянной
Авогадро.
Определите
массу кислорода в баллоне, если известно,
что давление, которое он оказывает на
стенки баллона при температуре 40 °C
равно
840 кПа. Число молекул равно постоянной
Авогадро.На рисунке дан график изменения состояния идеального газа в координатах p – T. Представьте этот процесс в координатах p – V и V – T.
В озеро, имеющее среднюю глубину 10 м и площадь поверхности 20 км2, бросили кристаллик поваренной соли массой 0,01 г. Сколько молекул соли оказалось бы в наперстке воды объемом 2 см3, зачерпнутой из озера, если полагать, что соль, растворившись, рвномерно распределилась во всем объеме воды?
Содержание отчёта:
Записать наименование и цель занятия.
Ответить на контрольные вопросы и получить допуск к работе.
Выполнить задания.
Контрольные вопросы:
Сформулировать основные положения МКТ.
Записать число Авогадро. Как рассчитать число молекул вещества?
Записать зависимость температуры от средней кинетической энергии. Чему равна постоянная Больцмана? Как перевести значение температуры, выраженной в градусах Цельсия в Кельвины?
Записать основное уравнение МКТ и универсальную газовую постоянную.
Сформулировать газовые законы для данной массы газа.
ПРИЛОЖЕНИЕ
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества. В основе молекулярно-кинетической теории лежат три основных положения:
Любое вещество состоит из мельчайших частиц — молекул и атомов. Они расположены в пространстве дискретно, то есть на некоторых расстояниях друг от друга.
Атомы или молекулы вещества находятся в состоянии беспорядочного движения , которое никогда не прекращается.
Атомы или молекулы вещества взаимодействуют друг с другом силами притяжения и отталкивания, которые зависят от расстояний между частицами.
Атом — это наименьшая частица данного химического элемента, сохраняющая все его химические свойства. Химических элементов не так много — все они сведены в таблицу Менделеева.
Молекула — это наименьшая частица данного вещества (не являющегося химическим элементом), сохраняющая все его химические свойства. Молекула состоит из двух или более атомов одного или нескольких химических элементов.
Количество вещества- физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе.
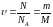
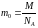
МОЛЬ - это количество вещества, равное 6,02.1023 структурных единиц данного вещества – молекул (если вещество состоит из молекул), атомов (если это атомарное вещество), ионов (если вещество является ионным соединением).
Основное уравнение МКТ:
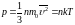
Уравнение состояния идеального газа:
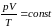 ,
при
,
при
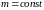
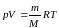
Изопроцессы и газовые законы:

