
- •Пример 1.
- •Решение.
- •Решение.
- •Пример 4.
- •Решение.
- •Пример 6.
- •Решение.
- •Решение.
- •Решение.
- •Пример 10.
- •Решение.
- •Решение.
- •Пример 12.
- •Р Рис. 30 ешение.
- •Пример 13.
- •Решение.
- •2.4. Задачи для самостоятельного решения
- •Контрольная работа 2
- •Основные физические постоянные (округлённые значения)
- •Относительные атомные массы (округлённые значения) и порядковые номера z некоторых элементов
![]() ,
,
где ni – число атомов i-го химического элемента, входящих в состав молекулы; Ari – отношение массы атома этого элемента к массе атома водорода (относительная атомная масса).
Число
n
молекул в единице объёма вещества
(концентрация молекул) равна числу
молекул в единице массы вещества NA/M,
делённому на плотность этого
![]() этого вещества:
этого вещества:
![]()
Количество вещества в случае смеси газов

где ![]() - соответственно количество вещества,
число молекул, масса и молярная масса
i-го компонента смеси.
- соответственно количество вещества,
число молекул, масса и молярная масса
i-го компонента смеси.
Из записи а) следует
![]() ,
,
где M - молярная масса смеси газов.
Основное уравнение кинетической теории газов:
давление
 ,
,
где n - число молекул в единице объёма; <Etr> - средняя кинетическая энергия поступательного движения одной молекулы; m - масса молекулы; <v2> - средний квадрат скорости молекулы.
Средняя полная кинетическая энергия молекулы
![]() ,
,
где i - число степеней свободы молекулы; k – постоянная Больцмана.
Давление идеального газа можно выразить через температуру T, концентрацию n и постоянную Больцмана (ещё одна запись уравнения состояния газа)
p = nkT .
Величина силы внутреннего трения, действующая между слоями жидкости или газа, выражается формулой
![]() ,
,
где
![]() -
величина градиента скорости течения
в направлении, перпендикулярном к
площадке S;
-
величина градиента скорости течения
в направлении, перпендикулярном к
площадке S; ![]() - коэффициент внутреннего трения
(динамическая вязкость).
- коэффициент внутреннего трения
(динамическая вязкость).
Для газа
![]() ,
,
где
![]() -
плотность газа.
-
плотность газа.
.
Примеры решения задач
Пример 1.
Определить массу моля M и массу m1 одной молекулы следующих веществ: 1) кислорода, 2) азота; 3) окиси азота (NO).
Решение.
В таблице 8 настоящего пособия находим относительные атомные массы элементов O и N (это же можно сделать и с помощью таблицы элементов Д.И.Менделеева): ArO = 16, ArN = 14.
Химические формулы молекул:
кислорода O2 nO = 2);
азота N2 (nN = 2);
окиси азота NO (nO = 1),(nN =1).
Молярную массу и массу одной молекулы находим по формулам:
![]() .
.
Получим:
1)кислород
![]()
2)азот
![]() ;
;
3)окись азота
![]() .
.
Пример 2.
Найти
число молекул N в 1 см3
и плотность для азота при давлении
![]() мм рт.ст. и температуре 15оС.
мм рт.ст. и температуре 15оС.
![]()
Решение.
Число
молекул в единице объема определяется
как n
= N/V, где
![]() - число молекул в количестве вещества
- число молекул в количестве вещества
![]() .
Из уравнения состояния найдём величину
.
Из уравнения состояния найдём величину ![]() :
:
![]() . (1)
. (1)
Тогда
![]() . (2)
. (2)
Переписав данные в системе СИ и подставив их в уравнение (2), получим
![]() .
.
Определив
массу из уравнения (1) m
= pVM/RT
и учитывая, что
![]() ,
найдем плотность газа:
,
найдем плотность газа:
![]() .
.
Пример
3.
В баллоне, объём которого 0,250 м 3,
находится газ, состоящий из смеси
углекислого газа и паров воды. Температура
газа 327 оС.
Число молекул углекислого газа
![]() ,
число молекул паров воды
,
число молекул паров воды
![]() .
Вычислить давление p и молярную массу
M газовой смеси.
.
Вычислить давление p и молярную массу
M газовой смеси.
Решение.
Давление смеси по закону Дальтона равно сумме парциальных давлений газов, входящих в состав смеси:
p = p1 + p2. (1).
Здесь индекс 1 относится к углекислому газу, индекс 2 – к парам воды.
На основе уравнения состояния идеального газа и молекулярных представлений для давлений p1 и p2 можно записать:
p1 = n1kT, (2) p2 = n2kT. (3)
Концентрации n1 и n2 легко выражаются через данные задачи:
n1 = N1/V; n2 = N2/V.
В результате для давления получаем
![]() (4)
(4)
Молярную
массу M определяем из соотношения
![]() .
Для массы смеси m формулу удобно
представить в виде
.
Для массы смеси m формулу удобно
представить в виде
m = m1N1 + m2N2, (5)
где m1 и m2 - массы молекул компонент смеси.
В
формуле (4) множитель (N1+N2)/NA
есть число молей смеси ![]() .
Поделив на этот множитель выражение
(5), получим формулу для молярной массы
газа:
.
Поделив на этот множитель выражение
(5), получим формулу для молярной массы
газа:
M = (M1N1+ M2N2)/(N1+ N2). (6)
Молярные массы углекислого газа M1 и паров воды M2 можно найти по способу, рассмотренному в примере 1. Они следующие:
![]() .
Подставив полученные значения в формулу
(6), получим молярную массу смеси газов:
.
Подставив полученные значения в формулу
(6), получим молярную массу смеси газов:
![]() .
.
Пример 4.
Определить среднюю кинетическую энергию молекулы кислорода, находящегося при температуре 17 оС. Во сколько раз она больше средней энергии молекулы гелия при той же температуре? Найти кинетическую энергию вращательного движения всех молекул, содержащихся в 4 г кислорода.
Решение.
У двухатомной молекулы кислорода число степеней свободы
i = 5. Кинетическая энергия её
![]() .
.
Молекулы гелия одноатомные, поэтому i = 3. Следовательно,
E1o/E1He = iO/iHe = 5/3 = 1,67.
Кинетическая энергия молекул кислорода в 1,67 раза больше кинетической энергии молекул гелия.
Вращательному движению двухатомной молекулы приписывается две степени свободы, поэтому энергия вращательного движения молекулы кислорода
Erot1 = 2(i/2)kT. (1)
Кинетическая энергия вращательного движения всех молекул кислорода
E = NErot1, (2)
где
N - число всех молекул газа, равное
произведению числа Авогадро NA и
числа молей
![]() ,
то есть
,
то есть
![]() . (3)
. (3)
Число молей
![]() . (4)
. (4)
Подставив (4) в (3), получим
N = NA(m/M). (5)
Подставив (5) в (2), имеем окончательно
E = NA(m/M)kT.
Подставив значения величин, получим E = 376 Дж.
Пример 5. Определить давления p1 и p2 газа, содержащего N = 1010 молекул и имеющего объём V = 2 cм3 при температурах T1 = 6 K и T2 = 1000 K.
Решение.
Из уравнения состояния определим давления идеального газа p1 и p2 для температур T1 и T2:
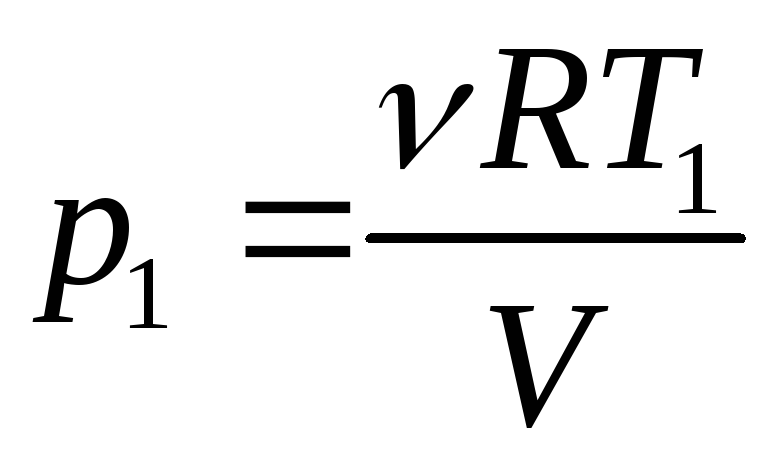 : (1)
: (1)
 . (2)
. (2)
Число молей найдём из соотношения
![]() . (3)
. (3)
Подставив (3) в (1) и (2), определим давления p1 и p2:
![]()
