
- •О сновные типы дефектов в кристаллической решетке оксидов и перенос вещества в решетке. Стехиометрические и нестехиометрические соединения.
- •К лассификация оксидных пленок по толщине. Теория Мотта и Кабреры для тонких пленок.
- •С тадии окисления металла. Физическая и химическая адсорбция.
- •Э питаксильный рост оксидной пленки. Псевдоморфный слой.
- •П родолжение
- •З аконы роста оксидных пленок и области применения этих законов. Защитные и незащитные пленки.
- •П родолжение
- •В иды напряжений и разрушений в оксидных пленках. Причины, вызывающие их.
- •И онно-электронный механизм окисления Me (теория Вагнера).
- •О ксидные пленки на железе и стали (состав, структура, свойства).
- •П родолжение
- •К оррозия металлов в газовых теплоносителях.
- •Продолжение
- •Э лектролитическая диссоциация. Слабые и сильные электролиты. Катодные и анодные участки поверхности и процессы, происходящие на них. Травление металлов.
- •Р абота микрогальванического элемента. Процессы, происходящие на электродах.
- •Продолжение
- •П ричины возникновения электрохимической гетерогенности поверхности раздела фаз.
- •П оложение элементов в ряду стандартных потенциалов.
- •Продолжение 1
- •Стандартные электродные потенциалы некоторых элементов в водных растворах при 25 ºС
- •П родолжение 2
- •Я вление поляризации и деполяризации. Виды поляризации и причины их возникновения. Влияние поляризации на скорость коррозии. Водородное и кислородное перенапряжение. Уравнение Тафеля.
- •П родолжение
- •П ассивность металлов и механизм ее возникновения. Пассиваторы и активаторы.
- •П родолжение
- •А нодная поляризационная диаграмма, ее характеристика и применение.
- •Э лектрохимическая защита металлов. Протекторная защита. Катодная защита.
- •Продолжение
- •В лияние внешних факторов на скорость электрохимической коррозии: ингибиторы и стимуляторы коррозии; состав и концентрация растворов; скорость движения электролита; влияние температуры.
- •П родолжение 1
- •П родолжение 2
- •П родолжение 3
- •К оррозия конструкционных материалов в пароводяном теплоносителе. Факторы, влияющие на коррозию в пароводяной среде.
- •Т ермический перенос массы в жидкометаллическом теплоносителе. Механизм и основные этапы переноса. Селективная коррозия металлов.
- •В лияние примесей в жидком металле на растворение и перенос массы компонентов твердого металла. Горячие и холодные ловушки.
- •Продолжение
- •С пособы снижения коррозии конструкционных материалов в жидкометаллических теплоносителях.
- •П родолжение
- •С овместимость как один из критериев при выборе конструкционных материалов для яэу.
С тадии окисления металла. Физическая и химическая адсорбция.
В результате химического взаимодействия металла с кислородом воздуха или другими окислителями (Cl, I, CO2, SO2 и др.) на его поверхности образуются пленки оксидов или других соединений, которые могут защищать металл от дальнейшего окисления. Процесс окисления (на примере образования оксидной пленки) твердого металла проходит через ряд последовательных стадий:
адсорбция молекулярного кислорода на чистой поверхности металла;
диссоциация молекул кислорода на атомы и их хемосорбция;
возникновение зародышей оксидов на локальных участках поверхности;
формирование и рост пленки оксида.
Для изучения процесса окисления необходимо наличие свежеприготовленной металлической поверхности. Такая поверхность, сформированная в условиях высокого вакуума или полученная быстрым изломом, имеет нерегулярную структуру (атомно-шероховатая поверхность) из-за наличия поверхностных дефектов и чужеродных атомов (примесей).
Адсорбция
кислорода на чистой металлической
поверхности
возможна в виде молекул, атомов и ионов:
О2,
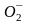 ,
,
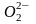 ,
О2–,
О–,
О. Молекулярная форма адсорбции (О2)
при положительных температурах
обнаруживается только на металлах,
оксиды которых в этих условиях нестабильны
(Ag, Hg, Pt, Au). Молекулы кислорода адсорбируются
на поверхности металла обратимо.
Критерием обратимости является
возможность увеличивать или уменьшать
степень заполнения поверхности металла
адсобированным кислородом посредством
изменения парциального давления его в
газовой фазе.
,
О2–,
О–,
О. Молекулярная форма адсорбции (О2)
при положительных температурах
обнаруживается только на металлах,
оксиды которых в этих условиях нестабильны
(Ag, Hg, Pt, Au). Молекулы кислорода адсорбируются
на поверхности металла обратимо.
Критерием обратимости является
возможность увеличивать или уменьшать
степень заполнения поверхности металла
адсобированным кислородом посредством
изменения парциального давления его в
газовой фазе.
На большинстве технических металлов адсорбция кислорода протекает необратимо с образованием прочных химических соединений. Молекулы адсорбата (кислорода) адсорбируются, прежде всего, в местах с высоким адсорбционным потенциалом, обладающим значительными силами притяжения (границы зерен, точки выхода краевых и винтовых дислокаций, вакансии, междоузлия и др.). Адсорбированные молекулы кислорода по мере заполнения площади поверхности и изменении ее температуры могут диссоциировать на атомы и взаимодействовать с молекулами или атомами адсорбента (металла). В зависимости от характера взаимодействия молекул адсорбента и адсорбата различают адсорбцию физическую и химическую (хемосорбцию). Физическая адсорбция наблюдается при низких температурах, близких к температуре конденсации адсорбата, и является результатом проявления дисперсионных сил и сил электростатического характера, аналогичных ван-дер-ваальсовым силам в реальных газах.
Физическая адсорбция протекает без заметной энергии активации и почти мгновенно, как только молекулы газа соударяются с поверхностью. Она не сопровождается химическим изменением молекул и может привести не только к образованию мономолекулярного слоя, но и к многослойному осадку частиц, а также к их миграции по поверхности. Теплота физической адсорбции, характеризующая прочность связи адсорбированных частиц с поверхностью металла, составляет 8–25 кДж/моль. В большинстве случаев поверхность твердого металла энергетически неоднородна. Она представляет собой серию элементарных площадок, обладающих различной теплотой адсорбции. Поэтому по мере заполнения однородной поверхности теплота адсорбции уменьшается.
При повышении температуры физическая адсорбция может переходить в хемосорбцию, если тепловая энергия превышает энергию активации такого процесса. Хемосорбция – результат химического взаимодействия адсорбированных атомов с атомами поверхностного слоя металла. При этом происходит переход электронов от металла к окислителю, что приводит к ионизации частиц и образованию между ними ионной или ковалентной связи. Теплоты хемосорбции значительно больше, чем при физической адсорбции, и изменяются в широких пределах от 80 кДж/моль для серебра до 800 кДж/моль для вольфрама. Хемосорбция зависит от кристаллографической ориентации дефектов на поверхности металла, а также от чистоты поверхности и химического сродства адсорбированного вещества (окислителя) к адсорбенту (металлу) и его электронам. Она проходит лишь до тех пор, пока на поверхности не образуется мономолекулярный слой адсорбата (кислорода).
