
- •О сновные типы дефектов в кристаллической решетке оксидов и перенос вещества в решетке. Стехиометрические и нестехиометрические соединения.
- •К лассификация оксидных пленок по толщине. Теория Мотта и Кабреры для тонких пленок.
- •С тадии окисления металла. Физическая и химическая адсорбция.
- •Э питаксильный рост оксидной пленки. Псевдоморфный слой.
- •П родолжение
- •З аконы роста оксидных пленок и области применения этих законов. Защитные и незащитные пленки.
- •П родолжение
- •В иды напряжений и разрушений в оксидных пленках. Причины, вызывающие их.
- •И онно-электронный механизм окисления Me (теория Вагнера).
- •О ксидные пленки на железе и стали (состав, структура, свойства).
- •П родолжение
- •К оррозия металлов в газовых теплоносителях.
- •Продолжение
- •Э лектролитическая диссоциация. Слабые и сильные электролиты. Катодные и анодные участки поверхности и процессы, происходящие на них. Травление металлов.
- •Р абота микрогальванического элемента. Процессы, происходящие на электродах.
- •Продолжение
- •П ричины возникновения электрохимической гетерогенности поверхности раздела фаз.
- •П оложение элементов в ряду стандартных потенциалов.
- •Продолжение 1
- •Стандартные электродные потенциалы некоторых элементов в водных растворах при 25 ºС
- •П родолжение 2
- •Я вление поляризации и деполяризации. Виды поляризации и причины их возникновения. Влияние поляризации на скорость коррозии. Водородное и кислородное перенапряжение. Уравнение Тафеля.
- •П родолжение
- •П ассивность металлов и механизм ее возникновения. Пассиваторы и активаторы.
- •П родолжение
- •А нодная поляризационная диаграмма, ее характеристика и применение.
- •Э лектрохимическая защита металлов. Протекторная защита. Катодная защита.
- •Продолжение
- •В лияние внешних факторов на скорость электрохимической коррозии: ингибиторы и стимуляторы коррозии; состав и концентрация растворов; скорость движения электролита; влияние температуры.
- •П родолжение 1
- •П родолжение 2
- •П родолжение 3
- •К оррозия конструкционных материалов в пароводяном теплоносителе. Факторы, влияющие на коррозию в пароводяной среде.
- •Т ермический перенос массы в жидкометаллическом теплоносителе. Механизм и основные этапы переноса. Селективная коррозия металлов.
- •В лияние примесей в жидком металле на растворение и перенос массы компонентов твердого металла. Горячие и холодные ловушки.
- •Продолжение
- •С пособы снижения коррозии конструкционных материалов в жидкометаллических теплоносителях.
- •П родолжение
- •С овместимость как один из критериев при выборе конструкционных материалов для яэу.
П родолжение
вследствие чего ток на катоде перераспределяется, и металл начинает осаждаться на тех участках катода, у которых концентрация раствора выше.
Повышенная концентрация ионов H+ у поверхности катода способствует их разрядке и усиливает растворение металла с анода. При значительном повышении концентрации ионов H+ процесс может перейти в обычное растворение металла в кислоте.
Замедленность диффузии ионов металла от поверхности анода в объем раствора приводит к возникновению концентрационной поляризации анода.
Концентрационная поляризация на аноде смещает потенциал электрода в направлении, противоположном направлению изменения потенциала при катодной поляризации.
2. Активационная поляризация является следствием замедленности электродной реакции, т.е. тем, что для начала электрохимической реакции на электроде требуется энергия активации, необходимая для существенной перестройки структуры реагирующих частиц в ходе реакции. Частицы, энергия которых больше или равна энергии активации, называются активными. Скорость электрохимических реакций, как и химических, может быть увеличена повышением температуры и применением катализатора. При повышении температуры растет доля активных молекул, при применении катализатора снижается энергия активации. Энергия активации может быть снижена и изменением потенциала электрода по сравнению с его равновесным значением на величину, необходимую для начала реакции.
Примером активационной поляризации может служить реакция восстановления гидратированных ионов водорода на катоде
H3O+ + e – → Hадс + H2O.
В результате разряда на металлическом электроде гидратированный ион водорода превращается в адсорбированный атом водорода, который, соединяясь с другим атомом, образует молекулу, удаляющуюся вместе с другими в виде газовых пузырьков из зоны реакции. Ввиду большой подвижности ионов водорода стадия подвода обычно не лимитирует реакцию.
Активационная поляризация для этого процесса называется водородным перенапряжением или перенапряжением выделения водорода. Активационная поляризация имеет место и при разряде ионов OH– на аноде с выделением кислорода:
2OH– → ½ O2 + H2O + 2e –.
Эта поляризация называется перенапряжением выделения кислорода. Если ясна причина, вызывающая поляризацию, то вместо термина поляризация часто употребляют термины электродное перенапряжение или просто перенапряжение.
Перенапряжением называют отклонение потенциала от равновесного значения, показывающее затрудненность электродного процесса, либо одной из его стадий. Затрудненность отдельных стадий электродного процесса характеризуется соответствующими перенапряжениями: ηи – перенапряжение реакции ионизации; ηр – перенапряжение химической реакции; ηд – перенапряжение стадии переноса (диффузии), когда наиболее затруднена доставка или отвод участников реакции взаимодействия.
Значения ηи и ηр можно рассчитать по известному уравнению Тафеля
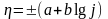 , (15.2)
, (15.2)
а перенапряжение диффузии – по уравнению
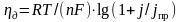 , (15.3)
, (15.3)
где j – плотность тока электродной реакции при данном значении потенциала, А/м2; jпр – предельная плотность тока диффузии, соответствующая максимальной скорости электродного процесса при данных условиях, А/м2, она определяется из уравнения
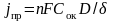 , (15.4)
, (15.4)
где Сок – концентрация окислителя в растворе электролита; D – коэффициент его диффузии, δ – толщина диффузионного слоя.
Знак «+» относится к анодному перенапряжению, а знак «–» к катодному. Константа b зависит от природы реакции, и температуры и при 298 К обычно имеет значение 0,1–0,12. Константа a зависит от природы реакции, материала электрода, состояния его поверхности, состава раствора и температуры, т.е. характеризует степень неравновесности данного электрода и при плотности тока, равной единице j = 1, равна перенапряжению.
