
- •Содержание
- •Общие указания
- •Варианты контрольных заданий
- •Варианты контрольных заданий
- •Введение.
- •2. Однокомпонентные системы
- •Д иаграмма состояния воды
- •2.2. Диаграмма состояния серы.
- •3. Двухкомпонентные системы.
- •3.1. Двухкомпонентные системы без химического взаимодействия.
- •3.1.1.Неизоморфные конденсированные системы
- •3.1.2. Изоморфные конденсированные двухкомпонентные системы.
- •3.1.3. Конденсированные системы с ограниченной растворимостью в твердом состоянии.
- •Двухкомпонентные системы с химическим взаимодействием веществ.
- •Криогидратные смеси.
- •4. Равновесие в системах без твердой фазы.
- •4.1. Система жидкостей с частичной взаимной растворимостью.
- •4.2. Системы жидкостей с неограниченной взаимной растворимостью.
- •4.3. Состав пара растворов.
- •4.4. Диаграммы состояния. Температура кипения растворов.
- •4.5. Перегонка растворов.
- •Правило рычага.
- •Закон распределения.
- •4.8. Экстракция.
- •5. Трехкомпонентные системы.
- •5.1. Применение правила фаз к трехкомпонентным системам.
- •5.2. Взаимная растворимость трех жидкостей.
- •6. Примеры решения задач
- •6.1. Правило фаз.
- •6.2. Диаграммы состояния.
- •Исключив m тв, получаем
- •6.3. Перегонка. Состав смеси.
- •6.4. Закон распределения. Экстракция.
- •7. Понятие о коллоидах.
- •8. Дисперсные системы.
- •8.1. Классификация дисперсных систем по величине частиц дисперсной фазы.
- •Свойства различных дисперсных систем
- •8.2. Классификация дисперсных систем по агрегатному состоянию.
- •Классификация дисперсных систем по агрегатному состоянию фаз и сред.
- •9. Методы получения коллоидных растворов.
- •9.1. Дисперсионные методы.
- •Метод растворения или метод самопроизвольного диспергирования
- •9.2. Конденсационные методы.
- •Ме электрическим методом Бредига
- •10. Строение коллоидных частиц
- •11. Электрофорез и электроосмос.
- •12. Очистка коллоидных растворов
- •12.1. Диализ.
- •12.2.Ультрафильтрация.
- •Относительные скорости очистки коллоидных растворов.
- •13. Молекулярно – кинетические свойства лиофобных коллоидов.
- •13.1. Броуновское движение.
- •13. 2. Седиментация
- •13. 3. Вязкость
- •13.4. Осмотическое давление.
- •14. Оптические свойства лиофобных коллоидов.
- •14.1. Светорассеяние
- •14.2. Ультрамикроскопические исследования
- •14.3.Нефелометрические измерения
- •14.4. Поглощение света
- •15. Примеры решения задач
- •16. Произведение растворимости. Примеры решения задач.
- •Влияние общего иона на растворимость малорастворимого электролита.
- •Влияние концентрации водородных ионов на растворимость малорастворимых электролитов.
- •17. Ионное произведение воды. Водородный и гидроксильный показатели. Примеры решения задач.
- •По значению ионного произведения воды
- •18. Буферные растворы. Примеры решения задач
- •4,510-4 Моля кислоты содержится в 27 мл раствора
- •Концентрация соли nн4сi равна взятой концентрации нсi. С учетом разбавления раствора:
- •Концентрацию nн4он находим по разности между начальной концентрацией nн4он (с учетом разбавления) и концентрацией нсi:
- •19. Поверхностные явления и адсорбция.
- •Примеры решения задач
- •20. Объёмный анализ.
- •20.1 Приемы и методы объемного анализа.
- •Метод нейтрализации;
- •20.2 Реакции, применяемые в объемном анализе.
- •20.3. Метод нейтрализации.
- •Титрование сильной кислоты сильной щелочью.
- •20.4. Индикаторы.
- •20.5. Потенциометрическое титрование.
- •Общий метод потенциометрического титрования. Титрование кислот и щелочей.
- •20.6. Кондуктометрическое титрование.
- •20.7.Примеры решения задач
- •Ответ: 33,53%; 53,76 %.
- •21. Задачи контрольных работ
- •1. Правило фаз Гиббса.
- •2. Фазовые диаграммы.
- •3. Перегонка. Состав смеси
- •4. Закон распределения. Экстракция.
- •5. Коллоидные растворы
- •6. Ионное произведение воды. Водородный и идроксильный показатели.
- •Буферные растворы.
- •Произведение растворимости
- •Поверхностные явления и адсорбция.
- •Потенциометрическое и кондуктометрическое титрование.
- •Дисперсные системы
- •Экзаменационные вопросы по курсу физическая и коллоидная химия
- •Пересчет водородного показателя (рН) на активность ионов
- •Сотые доли рН
- •Список литературы
3.1.2. Изоморфные конденсированные двухкомпонентные системы.




 3
3


 t
1 3 2 жидкая
фаза (расплав)
t
1 3 2 жидкая
фаза (расплав)



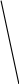 ликвидус
ликвидус
t1 t1 расплав +




 кристаллы
кристаллы
 t2
t2
тв.р - ра
t2
t2
тв.р - ра



 солидус
солидус

твердый р - р

 время
А100% х2
х0 состав
х3
х1 В%
время
А100% х2
х0 состав
х3
х1 В%
Рис. 3.3. Диаграмма плавкости изоморфной бинарной системы.
Изоморфные смеси образуются веществами со сходным строением кристаллических решеток. Поэтому оба вещества при любом соотношении кристаллизируются совместно и образуют твердый раствор.
При охлаждении смеси состава х0, соответствующей кривой 3 при температуре t1 появляется первый кристалл состава х1. Жидкость, теряя больше компонента В, чем А, обогащается легкоплавким компонентом; поэтому t ее отвердевания понижается. Составы жидкой и твердой фаз изменяются соответственно по кривым ликвидуса и солидуса. По мере понижения t (начиная с t1) охлаждения процесс замедляется, процентное содержание твердой фазы растет (это можно определить по правилу рычага).
При t2 затвердевает последняя капля расплава (состав х2) с образованием кристалла состава х3; после этого происходит охлаждение твердого раствора.
Характерной особенностью диаграмм плавкости систем с неограниченной взаимной растворимостью компонентов в жидком и твердом состоянии является отсутствие эвтектики.
Для этих систем известны три типа диаграмм плавкости. В системах первого типа при увеличении концентрации компонента температура начала кристаллизации твердого раствора непрерывно повышается. Линия ликвидуса имеет вид непрерывной кривой, все точки которой лежат между температурами кристаллизации чистых компонентов.
В системах второго типа t начала кристаллизации твердого компонента понижается при добавлении одного компонента к другому.
Линия ликвидуса имеет вид непрерывной кривой, проходящей через минимум.
В системах третьего типа t начала кристаллизации твердого раствора повышается при добавлении одного компонента к другому. Линия ликвидуса имеет вид непрерывной кривой, проходящей через максимум.
Согласно первому правилу Гиббса-Розебума, твердый раствор по сравнению с жидким раствором, находящимся с ним в равновесии, богаче тем компонентов, прибавление которого к расплаву повышает t начала кристаллизации твердого раствора.
По второму правилу Гиббса-Розебума в точках максимума и минимума кривых t плавления твердый раствор и находящийся с ним в равновесии жидкий расплав имеют одинаковый состав.



 t
расплав
t
расплав
t
расплав
t
расплав
расплав+кристаллы расплав+кристаллы



 твердого в
– ва твердого
в - ва
твердого в
– ва твердого
в - ва




кристаллы тв.р – ра кристаллы тв.р - ра


состав состав
Рис.3.4. Тип 2 Рис.3.5. Тип 3
