
История открытия ключевых регуляторов клеточного цикла
Александр Белый
Биологический факультет МГУ им. Ломоносова, Москва, Россия.
xbelyi@yandex.ru
Рецензент Арина Мазурова. Отправлено на рецензию и принято на рассмотрение 10.11.2014. Утверждено 11.11.2014
Резюме
Способность к самовоспроизведению является основной характеристикой всего живого. После каждого деления образовавшиеся дочерние клетки растут и развиваются, давая жизнь следующим поколениям. Деление подразумевает строго согласованные процессы клеточного роста и репликации ДНК, что позволяет поддерживать постоянство генетического материала. У эукариот, от одноклеточных дрожжей до млекопитающих, клеточный цикл контролируется консервативным семейством сериновых киназ, координирующих и связывающих воедино все внутриклеточные процессы. Интерес к изучению регуляторов клеточного цикла подогревается темой онкологии, при которой первопричиной является именно дисбаланс в регуляции клеточного цикла, приводящий к неконтролируемой клеточной пролиферации.
Введение
Цикл деления всех клеток можно разделить на 4 скоординированных последовательных процесса: клеточный рост, репликация ДНК, расхождение удвоенных хромосом к дочерним клеткам и, наконец, цитокинез. По сравнению с прокариотами, где репликация ДНК происходит непрерывно, синтез ДНК у эукариот происходит строго в определённое время, что, как и переход между другими стадиями, требует строгой регуляции.
Наблюдая под микроскопом культуру клеток, легко можно различить 2 стадии клеточного цикла – интерфазу, время роста и репликации ДНК, и митоз – непосредственное деление клетки, составляющее, как правило, около часа.
Более строго клеточный цикл разделяют на несколько фаз (рис. 1). Фаза G1 (gap 1) представляет собой интервал между предшествующим делением и инициацией репликации ДНК. В это время клетка метаболически активна, хромосомы деконденсированы и невидимы под микроскопом, с ДНК активно транскрибируются различные мРНК. При благоприятных условиях клетка вступает в фазу S (synthesis) – фазу репликации ДНК. В это время транскрипция приостанавливается лишь в участках репликации, где активны ДНК-зависимые ДНК-полимеразы. После репликации всей ДНК, наступает фаза G2 (gap 2). В это время активно синтезируются белки, необходимые для прохождения митоза (напр., тубулин); происходят деления митохондрий и хлоропластов (у растений), репликация центриолей и начало образования веретена деления. Если все предшествующие этапы пройдены, клетка вступает в митоз (фаза M).
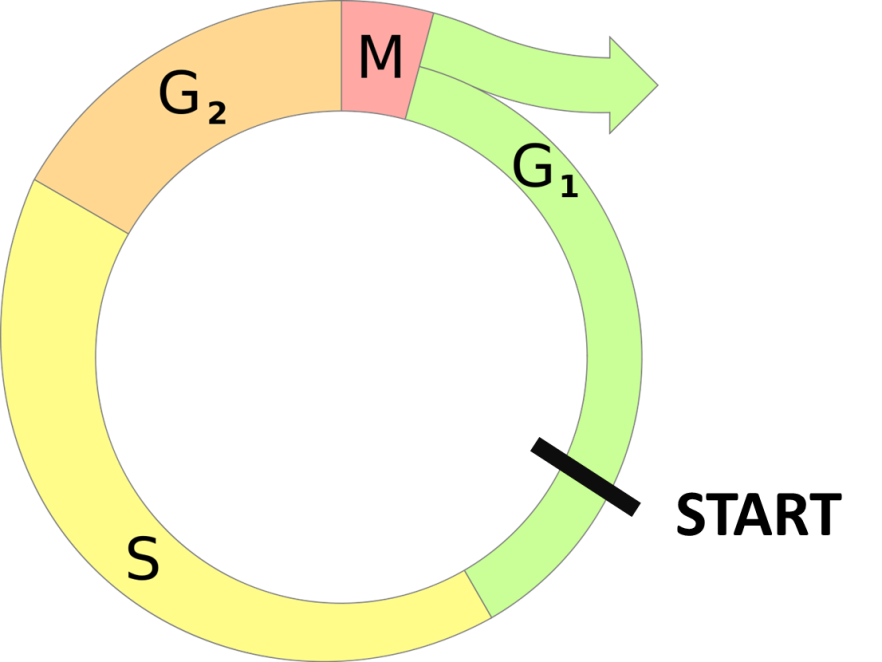
Рис. 1. Фазы клеточного цикла для пролиферирующей клетки млекопитающих. Фазы G1, S и G2 составляют интерфазу. M, митоз, как правило, заканчивается цитокинезом. Точка Start указывает на важнейший участок регуляции деления перед репликацией ДНК.
На каждом из вышеупомянутых этапов существуют точки контроля, не допускающие начало следующей фазы до полного прохождения текущей. Эти важнейшие участки были предметом исследования нескольких поколений учёных. Открытия трёх групп, составляющие фундамент сегодняшних исследований, были отмечены Нобелевским комитетом в 2001 году премией по физиологии и медицине. Лауреатами Нобелевской премии «…за открытие ключевых регуляторов клеточного цикла» стали Тим Хант, Пол Нёрс (Великобритания) и Лиланд Хартвел (США).
Открытие mpf (maturation promoting factor)
Эксперименты по трансплантации ядер и слиянию клеток, проведённые в 1960-х годах, явно показывали, что активность ядра всецело регулируется цитоплазмой. Однако непосредственное влияние требовалось доказать прямым экспериментом. Такой опыт был поставлен Йошио Масуи (Yoshio Masui) и Клементом Маркертом (Clement Markert) и представлен научной общественности в журнале Journal of Experimental Zoology в 1971 году.
Модельным организмом для этого ключевого эксперимента послужили ооциты лягушек, мейоз в которых останавливается в профазе мейоза I в ожидании действия прогестерона. Воздействие соответствующего гормона инициирует деление с последующей остановкой в метафазе мейоза II до самого оплодотворения. Учёные предположили, что прохождение через точки остановки регулируется цитоплазматическим фактором, образующимся в результате действия внеклеточного фактора.
В серии экспериментов исследователи проводили активацию ооцитов прогестероном, затем отбирали цитоплазму микропипеткой (рис. 2, А) и вводили в не активированные гормоном клетки. Наиболее значительный эффект наблюдался, когда цитоплазма доноров отбиралась после 6 и более часов со времени активации. Более того, индукция мейоза была прямо пропорциональна количеству введённой цитоплазмы (рис. 2, Б). Этот цитоплазматический фактор был назван MPF (maturation promoting factor).
Для того чтобы проверить, не является ли прогестерон искомым фактором, учёные вводили гормон с помощью микропипетки в неактивированные ооциты, однако это не вызывало мейоза. Таким образом, было явно установлено, что действие прогестерона снаружи клетки вызывает активацию какого-то внутриклеточного фактора, приводящего к делению.
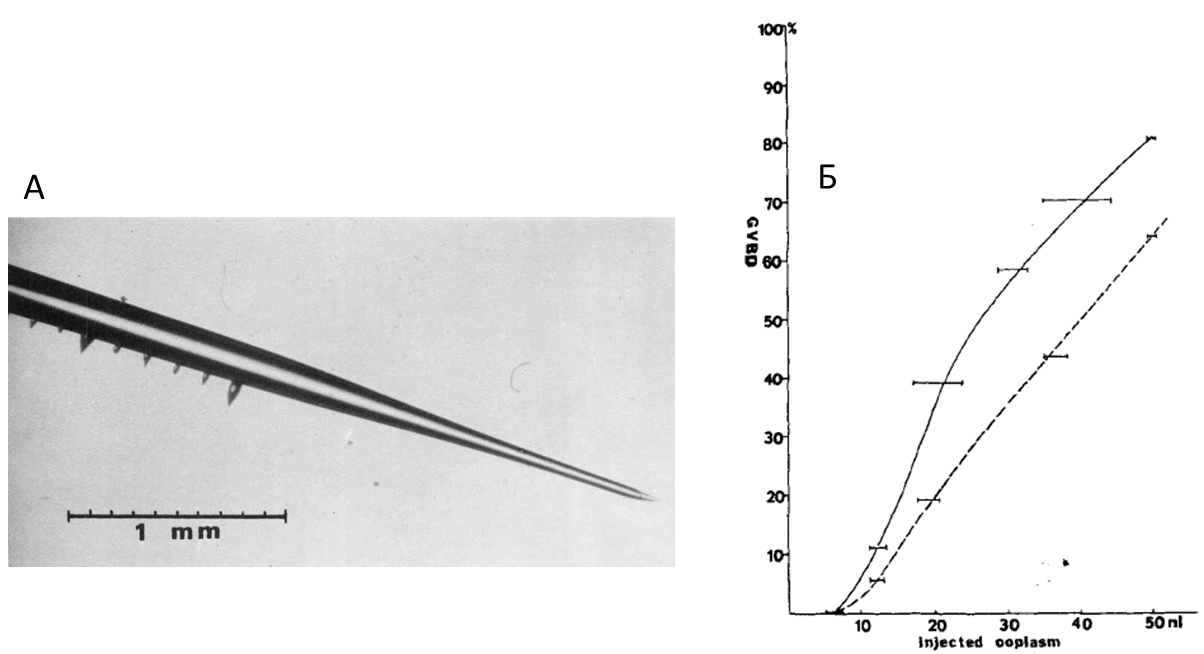
Рис. 2. А – фотография микропипетки, которой проводились манипуляции с цитоплазмой ооцитов. Б –график зависимости индукции мейоза (ось абсцисс, в %) от объёма введённой ооплазмы в клетки-доноры (ось ординат, в нл) Адаптировано из Masui, Merkert, J. of Experimental Zoology, 1971.
