
- •Лекция 1. Основные понятия и законы Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
- •Лекция 2. Строение атома
- •Ядро электронная оболочка
- •Уравнение де Бройля:
- •Число подуровней Подуровни
- •Лекция 2. Периодическая система элемнтов д.И. Менделеева
- •Валентные свойства атомов
- •Характер изменения свойств атомов и образованных ими простых соединений
- •Лекция 4. Химическая связь
- •3 Связи: σ- и две π – связи, механизм образования - обменный
- •Лекция 5. Метод валентных связей
- •Лекция 6. Взаимодействия между молекулами
- •Силы Ван-дер-Ваальса
- •Индукционная составляющая – электростатическое взаимодействие полярной и неполярной молекул или неполярной молекулы с внешним электростатическим полем.
- •Едисп увеличивается:
- •С увеличением поляризуемости молекул (атомов)
- •С уменьшением расстояния между частицами
- •Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
- •Лекция 8. Энергетика химических процессов
- •С (графит) 5,74 8,54
- •С (графит) 298 – 2300 к
- •Искомая область температур: 982 ÷ 2300 к
- •Лекция 11. Химическое равновесие
- •Лекция 12. Основные понятия химической кинетики
- •Влияние концентрации на скорость реакции
- •Лекция 13. Основы кинетики сложных и гетерогенных реакций
- •Лекция 14. Дисперсные системы и общие понятия о растворах Растворы
- •2. Газообразные: (газовые смеси) Воздух: о2, n2, Ar, н2о (пары)
- •Жидкие растворы
- •Растворы электролитов Растворы неэлектролитов
- •Способы выражения концентрации растворов.
- •Термодинамика процесса растворения
- •Основные стадии процесса растворения:
- •Законы идеальных растворов
- •Осмотическое давление
- •Закон Вант - Гоффа
- •Реальные растворы. Активность.
- •Лекция № 15. Растворы электролитов
- •Ступенчатая диссоциация
- •Расчет рН слабых кислот и оснований
- •Расчет рН сильных кислот и оснований
- •4 Типа солей
- •2) Соли, образованные слабым основанием и сильной кислотой
- •3) Соли, образованные сильным основанием и слабой кислотой
- •4) Соли, образованные слабым основанием и слабой кислотой
- •Гетерогенные равновесия врастворах малорастворимых сильных электролитов
- •Равновесие в растворах комплексных соединений
- •Лекция 17. Окислительно-восстановительные иэлектрохимические процессы
- •Лекция 18. Гальванический элемент
- •Компенсационным методом с помощью переменной внешней эдс
- •Лекция № 20. Электролиз
- •Электроды
- •В случае электролиза раствора Na2so4 (электроды Pt)
- •В случае электролиза раствора NaCl (электроды Pt)
- •Лекция 22. Скорость электрохимической коррозии.
- •Лекция 24. Химическая коррозия металлов
- •Лекция 25. Защита металлов от химической коррозии
- •Лекция 26. Определение возможности коррозии и надежности выбранного метода защиты металла на конкретных примерах
Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
Твердые веществамогут находиться в кристаллическом состоянии (подавляющее большинство)
кристаллические вещества имеют:
дальний порядок, т.е 3-хмерную
периодичность структуры по всему объему тела
зависимость свойств от направления в пространстве
(неодинаковы прочность, теплопроводность и т. п.) –
явление анизотропности
определенную Т пл
хлорид натрия (соль), графит, металлы
в аморфном состоянии (переохлажденные жидкости) аморфные вещества имеют:
только ближний порядок – упорядоченное расположение частиц на небольших расстояниях
одинаковые свойства во всех направлениях – явление изотропности
плавятся не при строго определенной температуре, а в некотором интервале Т
образуются при охлаждении ↓Тзам (кристаллизации нет)
B2O3, GeO2, P4O10, SiO2
Частицы твердого кристаллического тела: атомы, молекулы, ионы.
Положения частиц в кристалле: узлы
Трехмерное расположение узлов: кристалл
Простейшая часть кристалла: элементарная ячейка.
Из 14 типов ячеек наиболее распространенными являются:
простая кубическая, ПК
гранецентрированная, ГЦК
объемноцентрированная, ОЦК
гексагональная ГК
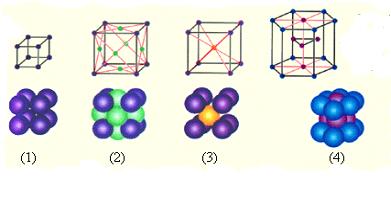
Виды кристаллов и их свойства
Молекулярные кристаллы
В узлах решетки: атомы или молекулы, связанные вандерваальсовами (слабыми) силами
Характеризуются:
↓ Е кр
малой механической прочностью
↓ Т пл
↑ летучестью
отсутствием электропроводности (диэлектрики)
↓ теплопроводностью
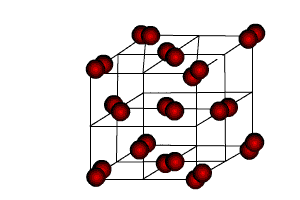 кристаллическая
структура I2
кристаллическая
структура I2
! Основной вклад величину Е кр вносит энергия химической или межмолекулярной связи между частицами в решетке
Е кр имеют кристаллы благородных газов (Ar, Ne…) и веществ с неполярными молекулами (СН4, СО2, BF3)
между частицами в кристалле:
слабое дисперсионное взаимодействие: Е кр ~ Е дисп
чем ↑α (поляризуемость частицы), тем ↑ Е дисп Þ ↑ Е кр
Е кр ↑ для веществ с полярными молекулами (РСl3, H2S)
между частицами в кристалле:
ориентационное, индукционное и дисперсионное
взаимодействия: Е кр ~ Е ор + Е инд + Е дисп
чем ↑ , тем ↑ Е ор, Е инд Þ ↑ Е кр
наиболее ↑Екр в молекулярных кристаллах с Н- связями
(NH3, H2O)
Е кр ~ Е ор + Е инд + Е дисп + Е Н-св
Атомно-ковалентные кристаллы В узлах решетки:
атомы, связанные ковалентными связями
- немногочисленны
- отдельной структурной единицы выделить нельзя
Характеризуются:
↑ Е кр
высокой механической прочностью
↑ Т пл
↑ Т кип
различной электропроводностью:
от диэлектриков: С(алмаз), SiO2 (кварц), BN
до полупроводников: Si, Ge
и даже проводников: Sn (олово серое)
Ионные кристаллы
В узлах решетки: ионы, связанные ионной связью
(KF, NaCl, CaF2, BeO, NaOH, CaCO3)
Характеризуются:
↑ Е кр
↑ прочностью (! хрупкие)
↑ Т пл
↓электропроводимостью (большинство диэлектрики)
! растворы и расплавы проводят электрический ток
↓ теплопроводностью
Кристаллическая решетка
NaCl

Для 1 моль идеального ионного кристалла
(уравнение Капустинского):
Еион.кр. ~ 107,13 n (( z+•z- /(R+ + R - )) (1)
n – число ионов в формуле кристалла
Металлические кристаллы
В узлах решетки: положительные ионы металлов, связанные металлической связью
(металлы, сплавы)
Характеризуются:
↑ электропроводимостью
↑ теплопроводностью
металлическим блеском
ковкостью и пластичностью
Eкр молек кр < Eкр металл кр < Eкр атом- ков кр
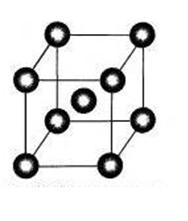 кристаллическая
решетка Na
кристаллическая
решетка Na
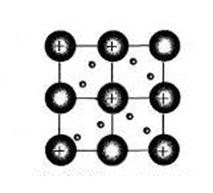 в узлах решетки
– катионы Ме,
в узлах решетки
– катионы Ме,
погруженные в «электронный газ» -
делокализованные валентные ē
Металлы
с чисто металлической (нелокализованной) связью:
s, p – металлы и d – металлы с завершенными предвнешними оболочками (нет неспаренных ē)
Характеризуются:
достаточно ↓ Eк , достаточно↓ Тпл
с металлическими и ковалентными связями (локализованными):
d, f – металлы, имеющие неспаренные (валентные) ē
Характеризуются: ↑ Eкр, ↑Т пл, твердостью
