
- •Лекция 1. Основные понятия и законы Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
- •Лекция 2. Строение атома
- •Ядро электронная оболочка
- •Уравнение де Бройля:
- •Число подуровней Подуровни
- •Лекция 2. Периодическая система элемнтов д.И. Менделеева
- •Валентные свойства атомов
- •Характер изменения свойств атомов и образованных ими простых соединений
- •Лекция 4. Химическая связь
- •3 Связи: σ- и две π – связи, механизм образования - обменный
- •Лекция 5. Метод валентных связей
- •Лекция 6. Взаимодействия между молекулами
- •Силы Ван-дер-Ваальса
- •Индукционная составляющая – электростатическое взаимодействие полярной и неполярной молекул или неполярной молекулы с внешним электростатическим полем.
- •Едисп увеличивается:
- •С увеличением поляризуемости молекул (атомов)
- •С уменьшением расстояния между частицами
- •Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
- •Лекция 8. Энергетика химических процессов
- •С (графит) 5,74 8,54
- •С (графит) 298 – 2300 к
- •Искомая область температур: 982 ÷ 2300 к
- •Лекция 11. Химическое равновесие
- •Лекция 12. Основные понятия химической кинетики
- •Влияние концентрации на скорость реакции
- •Лекция 13. Основы кинетики сложных и гетерогенных реакций
- •Лекция 14. Дисперсные системы и общие понятия о растворах Растворы
- •2. Газообразные: (газовые смеси) Воздух: о2, n2, Ar, н2о (пары)
- •Жидкие растворы
- •Растворы электролитов Растворы неэлектролитов
- •Способы выражения концентрации растворов.
- •Термодинамика процесса растворения
- •Основные стадии процесса растворения:
- •Законы идеальных растворов
- •Осмотическое давление
- •Закон Вант - Гоффа
- •Реальные растворы. Активность.
- •Лекция № 15. Растворы электролитов
- •Ступенчатая диссоциация
- •Расчет рН слабых кислот и оснований
- •Расчет рН сильных кислот и оснований
- •4 Типа солей
- •2) Соли, образованные слабым основанием и сильной кислотой
- •3) Соли, образованные сильным основанием и слабой кислотой
- •4) Соли, образованные слабым основанием и слабой кислотой
- •Гетерогенные равновесия врастворах малорастворимых сильных электролитов
- •Равновесие в растворах комплексных соединений
- •Лекция 17. Окислительно-восстановительные иэлектрохимические процессы
- •Лекция 18. Гальванический элемент
- •Компенсационным методом с помощью переменной внешней эдс
- •Лекция № 20. Электролиз
- •Электроды
- •В случае электролиза раствора Na2so4 (электроды Pt)
- •В случае электролиза раствора NaCl (электроды Pt)
- •Лекция 22. Скорость электрохимической коррозии.
- •Лекция 24. Химическая коррозия металлов
- •Лекция 25. Защита металлов от химической коррозии
- •Лекция 26. Определение возможности коррозии и надежности выбранного метода защиты металла на конкретных примерах
Лекция 6. Взаимодействия между молекулами
Конденсированное (жидкое, твердое) состояние вещества обусловлено межмолекулярными взаимодействиями
Основные виды:
●вандерваальсовы силы
●водородные межмолекулярные связи
●донорно-акцепторные взаимодействия
Силы Ван-дер-Ваальса
– силы межмолекулярного взаимодействия, проявляющиеся на расстояниях, превосходящих размеры частиц.
Три составляющие вандерваальсовых сил:
Ориентационная составляющая (диполь-дипольное взаимодействие)
- взаимодействие полярных молекул при их сближении
Е ориен уср ≈ 4 /( Т• r6)
Еориен увеличивается:
с увеличением
с уменьшением расстояния ( r) между молекулами
с понижением температуры (Т)
Индукционная составляющая – электростатическое взаимодействие полярной и неполярной молекул или неполярной молекулы с внешним электростатическим полем.
Диполи, действуя на неполярные молекулы, превращают их индуцированные (наведенные) диполи.
Еиндуср ≈ α • 2/r6
α - поляризуемость молекулы (атома)
● характеризует способность молекулы (атома)
деформироваться и поляризоваться (приобретать дипольный момент в электрическом поле)
● α ↑ с ↑ размеров, усложнением структуры и ↑ массы
молекулы
Еинд увеличивается:
с ↑
с ↓ расстояния между молекулами
с ↑ поляризуемости неполярной молекулы (атома)
Еинд < Еориен
Дисперсионная составляющая (эффект Лондона)
- взаимодействие мгновенных диполей, возникающих за счет смещения е- и атомных ядер под действием электрического поля
Едиспуср ≈ α2/r6
Едисп увеличивается:
С увеличением поляризуемости молекул (атомов)
С уменьшением расстояния между частицами
Еинд < Еориен < Едисп
Едисп существует в системе любых молекул
единственная составляющая вандерваальсовых сил для неполярных молекул
ЕВ-д-В = Еинд + Еориен + Едисп
ВОДОРОДНАЯ СВЯЗЬ
- связь, образованная положительно поляризованным водородом молекулы А – Н (или полярной группы –А – Н) и электроотрицательным атомом В другой или той же молекулы
А и В- атомы элементов с ↑ ЭО (F,O,N,…)
Поляризованный атом Н:
отсутствие внутренних ē –оболочек
значительный сдвиг ē –пары к атому с ↑ ЭО
малый размер
Þ имеет способность глубоко внедряться в
ē
-оболочку
![]() поляризованного
атома В
поляризованного
атома В
Межмолекулярная Н-связь:
А – Н + В – R ® А – Н×××В – R
Атомы А и В могут быть
одинаковыми: Нd+ – Fd- + Нd+ – Fd- ® H – F … H – F
 Н
Н
Н
Н
разными: F – H + O ® F – H ··· O
Н Н
Внутримолекулярная Н-связь
Ен-св возрастает с увеличением ЭО и уменьшением размеров атомов В:
Наиболее прочные связи с элементами 2- го периода:
-Н ... F- > -Н ... O= > -Н ... N≡
кДж/моль 25-42 13-19 8-21
!Несмотря на высокую ЭО у хлора Н - связь – Н…Сl- относительно слабая из-за большого размера атома хлора
Возникновение Н - связей приводит к образованию димеров, тримеров, полимерных структур (НF)n, кольцевых структур низших карбоновых кислот, спиральных структур белков
Межмолекулярные Н-связи сильно влияют свойства веществ
и повышают:
- вязкость
- диэлектрическую постоянную
- Ткип и Тплавл
! Н2О, НF и NН3 - аномально высокие Ткип и Тпл.
Донорно – акцепторное межмолекулярное взаимодействие
при взаимодействии одинаковых молекул приводит к образованию
неорганических полимеров (в твердом агрегатном состоянии)
(SiO2)n
(AlCl3)n
 (BaF2)n
неорганические полимеры
(BaF2)n
неорганические полимеры
при взаимодействии различных по природе молекул приводит к образованию комплексных соединений
CuSO4
+ 2NH4OH (СuOH)2SO4
+
(NH4)2SO4
(СuOH)2SO4
+
(NH4)2SO4
(СuOH)2SO4
+
8NH4OH [Cu(NH3)4](OH)2
+ [Cu(NH3)4]SO4
+ 8 H2O
комплексное
комплексная
соль
[Cu(NH3)4](OH)2
+ [Cu(NH3)4]SO4
+ 8 H2O
комплексное
комплексная
соль
основание
+
Теория кристаллического поля
Для комплексов, в которых КО являются ионы
d – элементов, имеющих от 1 до 9 ē на предвнешнем энергетическом уровне …(n-1) d 1-9
Лиганды располагаются вокруг КО так, чтобы силы притяжения были максимальны, а силы отталкивания минимальны
Неспаренные ē комплексообразователя, испытывая отталкивание от ē –пар лигандов с сильным полем, могут спариваться, переходя на более дальние от лигандов d-орбитали.
Лиганд сильного поля:
ē на d-подуровне КО максимально спариваются Þ низкоспиновые комплексы
Лиганд слабого поля:
спаривания ē на d-подуровне КО не происходит Þ высокоспиновые комплексы
Для 4-d-и 5-d-элементов – все лиганды сильного поля
Для 3-d-элементов – спектрохимический ряд лигандов
(в порядке возрастания силы поля):
.. .. .. .. .. .. .. .. .. .. ..
I–< Br–< Cl– < F– < ОН– < H2O < NCS– < NH3 < NO2– < NC– < CO
Границы между сильным и слабым полями лигандов условны:
лиганд F–: [NiF6]2–– сильное поле
[MnF6]2– – слабое поле
лиганд Н2О [Со(Н2О)6]2+ – сильное поле
[Со(Н2О)6]3+ – слабое поле
Лиганды влияют на энергетическое состояние d- AО КО.
В отсутствии внешнего электростатического поля все d-орбитали - вырожденные (имеют одинаковую Е)
Под воздействием поля лигандов Þ расщепление d-АО на величину D, называемую энергией расщепления D - зависит от КЧ, природы лигандов и природы КО
Координационное число = 6
октаэдрическое расщепление Е (n-1)d- орбиталей
структура комплекса октаэдр (всегда при к. ч. = 6)
Энергетическая диаграмма расщепления Е (n-1)d - АО
 !
!
Распределение электронов на (n-1)d-орбиталях зависит от силы поля лиганда
ПРИМЕР Комплекс [Co(Н2О)6]2+
комплексообразователь: Со2+ …3d74s0
К Ч= 6 Þ октаэдрическое расщепление
комплексообразователь – 3d – элемент Þ по спектрохимическому ряду: Н2О – лиганд среднего поля,
для Со+2 (низшая степень окисления) он относится к слабым
Энергетическая диаграмма расщепления Е АО d-подуровня

sp3d2-гибридизация
структура комплекса [Со(Н2О)6]2+ – октаэдр
комплекс – высокоспиновый (слабое поле лигандов)
внешнеорбитальный (все лиганды - на внешнем уровне)
! Чаще всего (но не всегда, см. К нест) внешнеорбитальныкомплексы менее проч ные, чем внутриорбитальные
! Магнитные свойства комплекса определяются наличием неспаренных ē на (n-1)de, g - орбиталях:
если неспаренные ē имеются Þ
комплекс – парамагнетик (слабые магнитные свойства) если неспаренных ē нет Þ комплекс – диамагнетик (нет магнитных свойств)
Со(Н2О)6]2+ – парамагнетик Þ втягивается в магнитное поле
Координационное число = 4
КО: катион 3d – металла: в поле слабых лигандов
Þ тетраэдрическое расщепление (см. спектрохимический ряд лигандов)
КО: катион 4d- или 5d- металла Þ все лиганды сильного поля Þ плоско-квадратное расщепление
ПРИМЕР. Комплекс [Au(NH3)4]3+
К О: …Au3+ 5d86s0
К Ч = 4
К О: 5d- элемент Þ лиганды сильного поля Þ
плоско-квадратное расщепление
Энергетическая диаграмма расщепления Е АО d-подуровня


dsp2- гибридизация АО
структура – плоский квадрат
комплекс:
внутриорбитальный
низкоспиновый
диамагнетик (нет неспаренных ē)
ПРИМЕР. Комплекс [NiCl4]2-
К О: …Ni2+ 3d84s2
К Ч = 4
КО – 3d- элемент Þ по спектрохимическому ряду:
Cl- – лиганд слабого поля Þ тетраэдрическое расщепление
Энергетическая диаграмма расщепления Е АО d-подуровня
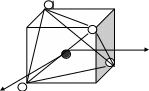
sp3-гибридизация АО
структура – тетраэдр
комплекс:
высокоспиновый
внешнеорбитальный Þ непрочный
парамагнетик (есть неспаренные ē)
ПРИМЕРЫ
Комплекс [AlBr4]-
атом Аl …3s23р1 (p-элемент)
комплексообразователь: Al3+ …3s03p0 (акцептор ē –пар)
л иганды:
Br-
(доноры
ē
–пар)
Br-
…4s2p6
иганды:
Br-
(доноры
ē
–пар)
Br-
…4s2p6
к .ч.
- 4
.ч.
- 4


…3s03p0 неподеленные ē–пары лигандов


:Br- :Br-:Br- :Br- sp3-гибридизация АО
строение комплексного иона
- тетраэдр
2. Комплекс [Sn(OH)6]2-
атом Sn …5s25p2
комплексообразователь: Sn4+ …5s05p0 (акцептор ē –пар)
лиганды: OH- (доноры ē –пар)
к.ч. - 6
5s 5 p 5d
 …5s05p0
…5s05p0
sp3d2-гибридизация АО
:OH- :OH- :OH- :OH- :OH- :OH-
 строение
комплексного иона - октаэдр
строение
комплексного иона - октаэдр
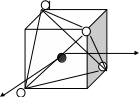
ПРИМЕР. Комплекс [NiCl4]2-
К О: …Ni2+ 3d84s2
К Ч = 4
КО – 3d- элемент Þ по спектрохимическому ряду:
Cl- – лиганд слабого поля Þ тетраэдрическое расщепление
Энергетическая диаграмма расщепления Е АО d-подуровня
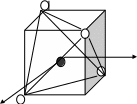
sp3-гибридизация АО
структура – тетраэдр
комплекс:
высокоспиновый
внешнеорбитальный Þ непрочный
парамагнетик (есть неспаренные ē)
