
- •Лекция 1. Основные понятия и законы Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
- •Лекция 2. Строение атома
- •Ядро электронная оболочка
- •Уравнение де Бройля:
- •Число подуровней Подуровни
- •Лекция 2. Периодическая система элемнтов д.И. Менделеева
- •Валентные свойства атомов
- •Характер изменения свойств атомов и образованных ими простых соединений
- •Лекция 4. Химическая связь
- •3 Связи: σ- и две π – связи, механизм образования - обменный
- •Лекция 5. Метод валентных связей
- •Лекция 6. Взаимодействия между молекулами
- •Силы Ван-дер-Ваальса
- •Индукционная составляющая – электростатическое взаимодействие полярной и неполярной молекул или неполярной молекулы с внешним электростатическим полем.
- •Едисп увеличивается:
- •С увеличением поляризуемости молекул (атомов)
- •С уменьшением расстояния между частицами
- •Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
- •Лекция 8. Энергетика химических процессов
- •С (графит) 5,74 8,54
- •С (графит) 298 – 2300 к
- •Искомая область температур: 982 ÷ 2300 к
- •Лекция 11. Химическое равновесие
- •Лекция 12. Основные понятия химической кинетики
- •Влияние концентрации на скорость реакции
- •Лекция 13. Основы кинетики сложных и гетерогенных реакций
- •Лекция 14. Дисперсные системы и общие понятия о растворах Растворы
- •2. Газообразные: (газовые смеси) Воздух: о2, n2, Ar, н2о (пары)
- •Жидкие растворы
- •Растворы электролитов Растворы неэлектролитов
- •Способы выражения концентрации растворов.
- •Термодинамика процесса растворения
- •Основные стадии процесса растворения:
- •Законы идеальных растворов
- •Осмотическое давление
- •Закон Вант - Гоффа
- •Реальные растворы. Активность.
- •Лекция № 15. Растворы электролитов
- •Ступенчатая диссоциация
- •Расчет рН слабых кислот и оснований
- •Расчет рН сильных кислот и оснований
- •4 Типа солей
- •2) Соли, образованные слабым основанием и сильной кислотой
- •3) Соли, образованные сильным основанием и слабой кислотой
- •4) Соли, образованные слабым основанием и слабой кислотой
- •Гетерогенные равновесия врастворах малорастворимых сильных электролитов
- •Равновесие в растворах комплексных соединений
- •Лекция 17. Окислительно-восстановительные иэлектрохимические процессы
- •Лекция 18. Гальванический элемент
- •Компенсационным методом с помощью переменной внешней эдс
- •Лекция № 20. Электролиз
- •Электроды
- •В случае электролиза раствора Na2so4 (электроды Pt)
- •В случае электролиза раствора NaCl (электроды Pt)
- •Лекция 22. Скорость электрохимической коррозии.
- •Лекция 24. Химическая коррозия металлов
- •Лекция 25. Защита металлов от химической коррозии
- •Лекция 26. Определение возможности коррозии и надежности выбранного метода защиты металла на конкретных примерах
Валентные свойства атомов
Валентность
показывает число химических связей, которое может образовать данный атом
зависит от числа неспаренных е- на внешнем и незавершенных энергетических подуровнях
в большинстве случаев совпадает с № группы, в которой находится элемент
различают валентность атома в основном (В) и возбужденном (В*) состояниях
! Распаривание е- при образовании возбужденных валентностей атома происходит в пределах одного энергетического уровня
Валентность: s- элементы
11Na [Ne] 3s1 …3s1
12Mg [Ne] 3s2 …3s2
р- элементы:
О и F: возбужденного состояния нет.
Cl …. 3s23p5 – электронный аналог фтора.
Валентности:
В = 1,
В*= 3, 5, 7, т.к. имеются свободные 3d – орбитали.

d- элементы
Для большинства d-элементов валентность в основном состоянии равна 0, т.к. на внешнем уровне нет неспаренных е-.
При переходе в возбужденное состояние s-электроны распариваются. При этом, кроме внешних валентными становятся неспаренные d-электроны предвнешнего подуровня.
27Cо [Ar]3d74s2 …3d74s2
Элементы одной подгруппы – аналоги е- - структуры.
и р – элементы находятся в главных подгруппах.
d- и f- элементы – в побочных.
Характер изменения свойств атомов и образованных ими простых соединений
в периоде:
количество квантовых слоев одинаково
заряд ядра ↑слева направо
в этом же направлении:
Е ионизации (I) валентных е- ↑
орбитальный радиус атомов (с. 333) ↓
↑ окислительные свойства атомов
↑ неметаллический характер простых веществ
в подгруппах (вниз по подгруппе):
↑ заряд ядер
↑количество квантовых слоев
Эти тенденции действуют противоположно на величину энергии ионизации I.
Важным фактором становится степень экранирования заряда ядра (предыдущими слоями)
– уменьшение воздействия положительно заряженного ядра на валентные е-.
у атомов элементов главных подгрупп:
квантовые слои предыдущие валентным е- заполнены,
эффект экранирования сильный
вниз по подгруппе (А):
энергия ионизации ↓
орбитальный радиус ↑
↑ восстановительные свойства атомов
↑ металлический характер простых соединений
у атомов элементов побочных подгрупп (Б) :
d-оболочка предвнешнего слоя не завершена
эффект экранирования относительно слабый
Таким образом,
энергия ионизации валентных е- у атомов d- и f- элементов в 1.5 – 2 раза выше, чем у атомов s- и p- элементов, стоящих с ними в одном периоде;
самым сильным восстановителем в этих подгруппах является 2 –ой (сверху) элемент.
Лекция 4. Химическая связь
Химическая связь – совокупность сил, действующих между частицами и обусловливающих образование устойчивых структуры: молекул, ионов, кристаллов и других систем.
! при образовании химической связи всегда выделяется Е
Основные типы химической связи
ионная
ковалентная
металлическая
Основные параметры химической связи
Энергия связи Есв, кДж/моль - количество энергии, выделяющееся при образовании химической связи в расчете на 1 моль вещества.
Длина связи lсв, нм - расстояние между ядрами химически связанных атомов.Зависит от размеров е--оболочек и степени их перекрывания
КОВАЛЕНТНАЯ СВЯЗЬ
Химическая связь, образованная путем обобществления пары е- двумя атомами называется ковалентной.
Сопровождается образованием:
- общей пары е- ,
- повышенной е- - плотности между атомами;
Образуется:
- только при взаимодействии е- с антипараллельными спинами (принцип Паули);
 Зависимость
энергии систем из 2-х атомов водорода с
антипараллельным (1)
и параллельными (2)
спинами от расстояния между ядрами.
Зависимость
энергии систем из 2-х атомов водорода с
антипараллельным (1)
и параллельными (2)
спинами от расстояния между ядрами.
Е – энергия связи, l – длина связи
При сближении двух атомов Н с параллельными спинами е- (↑↑) с ↓расстояния между ними, Е системы возрастает → связь не образуется
Если спины е- противоположно направлены (↑↓), на определенном расстоянии Е системы из двух атомов минимальна (Е min) → образуется молекула


+
+
+

Н Н Н2
Есв
= Е
образования
молекулы nсвязей
nсвязей
N + 3H = NH3
Е образования молекулы =1170 кДж/моль, Есв N-H =1170/3 = 390 кДж/моль
связь |
Есв, кДж /моль |
lсв, нм |
Вывод |
F – F |
159,0 |
0,142 |
Rат↓, lсв↓ Есв ↑ |
H – H |
436,0 |
0,074 |
связь |
Есв, кДж /моль |
lсв, нм
|
Вывод |
H – Cl |
427,0 |
0,128 |
Rат (галогена) ↑, lсв↑ Есв ↓ |
H - Br |
361,0 |
0,162 |
|
H – I |
294,0 |
0,412 |
ВЫВОДЫ:
! Чем ↑ Есв , тем она прочнее
! Чем ↓lсв, тем ↑ Есв и устойчивее молекула
Механизмы образования ковалентной связи
обменный
донорно-акцепторный
Обменный механизм - каждый из двух связываемых атомов выделяет для обобществленной пары по одному неспаренному е-
Донорно-акцепторный механизм - из двух связываемых атомов один (донор) выделяет неподеленную пару е-, а другой (акцептор) – свободную орбиталь
Обменный
Донорно-акцепторный

А –акцептор, D – донор
Ион аммония:
 Механизмы образования
связей:
Механизмы образования
связей:
три связи - по обменному механизму,
одна связь - по донорно-акцепторному: ‘N’-донор,‘H+’-акцептор
Схема образования молекулы оксида углерода (II) СО
C O



Механизмы образования связей:
две связи по обменному механизму,
одна связь по донорно-акцепторному: ‘O’-донор,‘C’-акцептор.
! Валентности ‘C’ и ‘O’ в молекуле СО равны 3
В атома = Вобм + В д-а
Частный случай д-а взаимодействия: дативные связи – образуются, когда АО одного атома, могут выступать одновременно в роли и донора и акцептора неподеленных пар е-.
С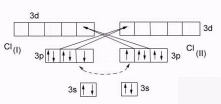 хема
образования молекулы
Cl2
хема
образования молекулы
Cl2
! Есв(Сl2) = 243 кДж/моль и ↑ , чем Есв(F2) = 159 кДж/моль,
несмотря на то, что lсв (Сl2) > lсв(F2)
СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИ
1.Насыщаемость
В образовании связи могут участвовать только валентные е-
! Атом образует не любое, а ограниченное число связей
2.Направленность
АО пространственно ориентированы
Перекрывание орбиталей происходит в определенных направлениях Þ молекулы имеют определенную пространственную структуру
Типы ковалентной связи
σ – связь π – связь δ - связь
s - связь образуется при перекрывании АО по линии, соединяющей ядра взаимодействующих атомов
Молекула Cl2 Cl …3s23p5
Cl …3s23p5
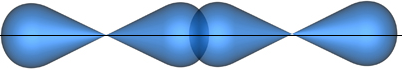
р-р – перекрывание, σ- связь, механизм образования - обменный
структура молекулы - линейная
 Молекула
Н2
Молекула
Н2
H …1s1
H …1s1 s-s – перекрывание σ- связь
механизм образования - обменный
структура молекулы -линейная
! Любая одинарная связь в молекуле - s - связь
угол между s - связями – валентный угол (Ð)
π – связь – образуется при боковом перекрывании двух р – облаков, расположенных перпендикулярно линии, соединяющей ядра взаимодействующих атомов
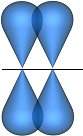
Если у взаимодействующих атомов имеются дополнительные неспаренные е, наряду с s - связью м.б. образованы дополнительные π – связи.
(=), ( ≡) - кратные связи
Кратность связи - число хим. св. между двумя взаимодействующими частицами
О2 N2
О = О N ≡ N
Кратность связи = 2 Кратность связи = 3

