
- •Лекция 1. Основные понятия и законы Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
- •Лекция 2. Строение атома
- •Ядро электронная оболочка
- •Уравнение де Бройля:
- •Число подуровней Подуровни
- •Лекция 2. Периодическая система элемнтов д.И. Менделеева
- •Валентные свойства атомов
- •Характер изменения свойств атомов и образованных ими простых соединений
- •Лекция 4. Химическая связь
- •3 Связи: σ- и две π – связи, механизм образования - обменный
- •Лекция 5. Метод валентных связей
- •Лекция 6. Взаимодействия между молекулами
- •Силы Ван-дер-Ваальса
- •Индукционная составляющая – электростатическое взаимодействие полярной и неполярной молекул или неполярной молекулы с внешним электростатическим полем.
- •Едисп увеличивается:
- •С увеличением поляризуемости молекул (атомов)
- •С уменьшением расстояния между частицами
- •Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
- •Лекция 8. Энергетика химических процессов
- •С (графит) 5,74 8,54
- •С (графит) 298 – 2300 к
- •Искомая область температур: 982 ÷ 2300 к
- •Лекция 11. Химическое равновесие
- •Лекция 12. Основные понятия химической кинетики
- •Влияние концентрации на скорость реакции
- •Лекция 13. Основы кинетики сложных и гетерогенных реакций
- •Лекция 14. Дисперсные системы и общие понятия о растворах Растворы
- •2. Газообразные: (газовые смеси) Воздух: о2, n2, Ar, н2о (пары)
- •Жидкие растворы
- •Растворы электролитов Растворы неэлектролитов
- •Способы выражения концентрации растворов.
- •Термодинамика процесса растворения
- •Основные стадии процесса растворения:
- •Законы идеальных растворов
- •Осмотическое давление
- •Закон Вант - Гоффа
- •Реальные растворы. Активность.
- •Лекция № 15. Растворы электролитов
- •Ступенчатая диссоциация
- •Расчет рН слабых кислот и оснований
- •Расчет рН сильных кислот и оснований
- •4 Типа солей
- •2) Соли, образованные слабым основанием и сильной кислотой
- •3) Соли, образованные сильным основанием и слабой кислотой
- •4) Соли, образованные слабым основанием и слабой кислотой
- •Гетерогенные равновесия врастворах малорастворимых сильных электролитов
- •Равновесие в растворах комплексных соединений
- •Лекция 17. Окислительно-восстановительные иэлектрохимические процессы
- •Лекция 18. Гальванический элемент
- •Компенсационным методом с помощью переменной внешней эдс
- •Лекция № 20. Электролиз
- •Электроды
- •В случае электролиза раствора Na2so4 (электроды Pt)
- •В случае электролиза раствора NaCl (электроды Pt)
- •Лекция 22. Скорость электрохимической коррозии.
- •Лекция 24. Химическая коррозия металлов
- •Лекция 25. Защита металлов от химической коррозии
- •Лекция 26. Определение возможности коррозии и надежности выбранного метода защиты металла на конкретных примерах
Число подуровней Подуровни
n l в уровне в уровне
1 0 1 1s
2 0, 1 2 2s, 2p
3 0, 1, 2 3 3s, 3p, 3d
4 0, 1, 2, 3 4 4s, 4p, 4d, 4f
Орбитали с l = 0, называются s-орбиталями (облаками) и имеют сферическую форму.

е- с l = 0 → s-электроны.
Орбитали с l = 1 - р-орбитали.

е- с l = 1 →р-электроны
Орбитали с l = 2 - d-орбитали.

е- с l = 2 → d-электроны.
Орбитали с l = 3 - f- орбитали. (см. Интернет).
е- с l = 3 → f- электроны.
3. Магнитное квантовое число (ml) -
величина проекции орбитального момента импульса е- на направление магнитного поля.
характеризует ориентацию АО в пространстве
принимает целые значения от –l до + l
число значений ml = 2l + 1= числу АО в подуровне = числу
возможных расположений е- - облака данного типа в пространстве.
Число АО
е- l ml с данным l
s
0 0
1 (![]() )
)
p 1 -1, 0, +1 3 ( )
d 2 -2, -1, 0, +1,+2 5 ( )
f 3 -3, -2, -1, 0, +1,+2,+3 7 ( )
Общее число АО (n, l, ml = const) в энергетическом уровне равно n2.
Вывод: АО полностью определяется набором из 3-х квантовых чисел n, l, ml, т.е. характеризуется определенными размерами, формой и ориентацией в пространстве.
4. Cпиновое квантовое число (ms)
«спин» - от англ. «веретено», «вращаться»
- собственный механический момента импульса е-,
связанный с движением его около своей оси
принимает значения +1/2 или – 1/2
обозначается графически
 или
или
Вывод: Состояние любого е- в атоме может быть полностьюохарактеризовано набором из 4 - х квантовых чисел
Распределение электронов в многоэлектронных атомах.
ОСНОВНЫЕ ПРИНЦИПЫ И ПРАВИЛА
Принцип минимальной энергии
Максимальной устойчивости системы соответствует минимум ее Е. е- вначале заселяют АО с меньшей Е (наиболее близкие к ядру).
1s < 2s <2р< 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d £ 4f < 6p < 7s и т. д.
увеличение Е
Принцип (запрет)Паули
В атоме не может быть двух е- с одинаковым набором всех 4-х квантовых чисел.
Следствия из принципа Паули
1. На одной АО могут находиться не более двух е-,
отличающихся друг от друга значениями спиновых квантовых чисел.
2. Максимальное число е- на каждом энергетическом уровне Nn= 2n2.
3. Максимальное число е- на каждом подуровне Nl = 2(2l+1).
![]() n,
l
– главное и орбитальное квантовые числа
n,
l
– главное и орбитальное квантовые числа
Правило Гунда
В пределах энергетического подуровня е- располагаются так, чтобы их суммарный спин был максимальным, знак суммы не имеет значения.
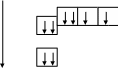
Распределение е- в атомах
графическое
в виде формул
Е p
 s
8О
1s22s22p4
s
8О
1s22s22p4
n = 2 или 8О [He]2s22p4
8О
n = 1
8О …2s22p4
Сокращенная (краткая) е- -формула (или валентная конфигурация) содержит только все внешние е- и е- формирующихся подуровней.
