
- •Лекция 1. Основные понятия и законы Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
- •Лекция 2. Строение атома
- •Ядро электронная оболочка
- •Уравнение де Бройля:
- •Число подуровней Подуровни
- •Лекция 2. Периодическая система элемнтов д.И. Менделеева
- •Валентные свойства атомов
- •Характер изменения свойств атомов и образованных ими простых соединений
- •Лекция 4. Химическая связь
- •3 Связи: σ- и две π – связи, механизм образования - обменный
- •Лекция 5. Метод валентных связей
- •Лекция 6. Взаимодействия между молекулами
- •Силы Ван-дер-Ваальса
- •Индукционная составляющая – электростатическое взаимодействие полярной и неполярной молекул или неполярной молекулы с внешним электростатическим полем.
- •Едисп увеличивается:
- •С увеличением поляризуемости молекул (атомов)
- •С уменьшением расстояния между частицами
- •Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
- •Лекция 8. Энергетика химических процессов
- •С (графит) 5,74 8,54
- •С (графит) 298 – 2300 к
- •Искомая область температур: 982 ÷ 2300 к
- •Лекция 11. Химическое равновесие
- •Лекция 12. Основные понятия химической кинетики
- •Влияние концентрации на скорость реакции
- •Лекция 13. Основы кинетики сложных и гетерогенных реакций
- •Лекция 14. Дисперсные системы и общие понятия о растворах Растворы
- •2. Газообразные: (газовые смеси) Воздух: о2, n2, Ar, н2о (пары)
- •Жидкие растворы
- •Растворы электролитов Растворы неэлектролитов
- •Способы выражения концентрации растворов.
- •Термодинамика процесса растворения
- •Основные стадии процесса растворения:
- •Законы идеальных растворов
- •Осмотическое давление
- •Закон Вант - Гоффа
- •Реальные растворы. Активность.
- •Лекция № 15. Растворы электролитов
- •Ступенчатая диссоциация
- •Расчет рН слабых кислот и оснований
- •Расчет рН сильных кислот и оснований
- •4 Типа солей
- •2) Соли, образованные слабым основанием и сильной кислотой
- •3) Соли, образованные сильным основанием и слабой кислотой
- •4) Соли, образованные слабым основанием и слабой кислотой
- •Гетерогенные равновесия врастворах малорастворимых сильных электролитов
- •Равновесие в растворах комплексных соединений
- •Лекция 17. Окислительно-восстановительные иэлектрохимические процессы
- •Лекция 18. Гальванический элемент
- •Компенсационным методом с помощью переменной внешней эдс
- •Лекция № 20. Электролиз
- •Электроды
- •В случае электролиза раствора Na2so4 (электроды Pt)
- •В случае электролиза раствора NaCl (электроды Pt)
- •Лекция 22. Скорость электрохимической коррозии.
- •Лекция 24. Химическая коррозия металлов
- •Лекция 25. Защита металлов от химической коррозии
- •Лекция 26. Определение возможности коррозии и надежности выбранного метода защиты металла на конкретных примерах
В случае электролиза раствора Na2so4 (электроды Pt)
[- K]: 2Н+ + 2е → Н2↑
[+A]: 4ОН- → О2 ↑ + 2Н2О + 4е один процесс на аноде
В случае электролиза раствора NaCl (электроды Pt)
[- K]: 2Н+ + 2е → Н2↑
[+A]: 4ОН- → О2 ↑ + 2Н2О + 4е два процесса на аноде
2Cl- → Cl2 ↑ + 2е
Задача.
Рассмотрите электролиз раствора Na2SO4 на растворимых Ni-электродах. Напишите уравнения процессов электролиза. Рассчитайте массы и объемы выделившихся газов (приведенные к н.у.), которые образуются на электродах за 0,2 часа при токе 5А. Вi(О2)=60%.
Решение. Ионный состав раствора:
Na2SO4 ж → 2Na+p + SO42-p
Н2Ож ↔ Н+р + ОН-р
(соль образована сил. осн. и сильн. кислотой нет гидролиза) рН = 7
Равновесные потенциалы возможных электродных процессов
[- K]: Е0Na+/ Na = - 2,9В ЕрН+/Н2 = -0,059рН = -0,41В
[+A]: SO42- - не окисляется, ЕрО2/ОН- =1,23-0,059рН=0,82В
Е0Ni2+/ Ni = - 0,025В ∆E < 1 два процесса
[- K]: 2Н+ + 2е → Н2↑ 100%
[+A]: 4ОН- → О2 ↑ + 2Н2О + 4е 60%
Ni0 → Ni2+ + 2e 40%
По закону Фарадея
 г
г
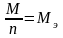
 г
г
Рассчитаем объем (при н.у. 1 моль газа V0m = 22,4 л)
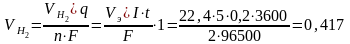 л
л

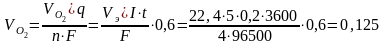 л
л
Применение электролиза
ЭЛЕКТРОЛИЗ
Оксидирование
Анодирование
ЭХОМ
Размерная обработка
Гальваника
мет. покрытия
Химическая промышленность
Получение хлора,
щелочей, др.
Металлургия
Электрорафинирование,Al,Mg



Гальванотехника включает гальваностегию и гальванопластику
1. Гальваностегия – нанесение металлических покрытий на поверхность изделия путем электролиза (никелирование, меднение, хромирование и др.)
. Электролит – водный раствор соли металла, кот. наносят.
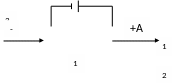 Изделие Þ
катод Анод Þ
металл покрытия
Изделие Þ
катод Анод Þ
металл покрытия
[+A]: Мепокр → Меn+р-р + ne
[- K]: Меn+р-р + ne → Мепокр
Защита от коррозии
Защитно-декоративное
Повышение электропроводности
Повышение твердости и износостойкости
Получение магнитных пленок
Уменьшение коэффициента трения
Улучшение способности к пайке
Улучшение отражательной способности поверхности
Пример. Электрохимическое никелирование.
Напишите уравнения катодного и анодного процессов. Предложите материал анода и электролит. Обоснуйте выбор.
Рассчитайте массу и толщину никелевого покрытия на стальном изделии поверхностью 1 м2 и изменение массы и толщины Ni -анода поверхностью 1 м2 при э/х никелировании в течение 1 ч из водного раствора на основе NiSO4, если катодная плотность тока – 100 А/м2, а анодная – 50 А/м2. Выход по току Ni на катоде – 80%, а на аноде – 90%. Плотность Ni ρ=8,9 г/см3. (Гидролизом пренебречь, рН≈7).
Решение.
Как показано выше, анод лучше брать из того же металла, что и покрытие (растворяясь, он поставляет соответствующие ионы в раствор).
Электролит должен содержать ионы металла-покрытия, быть хорошо растворимым, например NiSO4.
Сравнивая значения электродных потенциалов, записываем последовательность возможных электродных процессов:
[- K]: Ni2+ + 2e → Ni
2Н+ + 2е → Н2↑
[+A, Ni]: Ni → Ni2+ + 2e
4ОН- → О2 ↑ + 2Н2О + 4е
По закону Фарадея
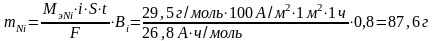
Толщина Ni покрытия на изделии равна:
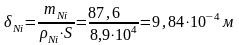 ≈0,98
мм
≈0,98
мм
Уменьшение массы никелевого анода:
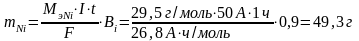
Изменение толщины Ni анода:
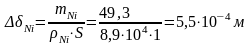 =
0,55 мм
=
0,55 мм
2) Гальванопластика – получение тонкостенных изделий сложной формы путем электролиза. Так, в приборостроении на основу наносят металл малой толщины путем электролиза, а затем химически растворяют основу.
К: Аl3++3e =Al
Электролиз в металлургии – рафинированиe
Рафинирование – очистка металлов от примесей.
На аноде – растворяются очищаемый М и примеси, Е0 которых < Е0М
Е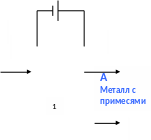 сли
Е0примесей
> Е0М
они не растворяются и выпадают на дно
ванны в виде шлама
сли
Е0примесей
> Е0М
они не растворяются и выпадают на дно
ванны в виде шлама
-K
инертный
электрод, Металл c
подложка примесями
Раствор Н2SO4
Пример: основной М – Ni; примеси – Zn и Cu.
Рассмотрите процесс рафинирования Ni, содержащего примеси Zn и Cu в растворе H2SO4. Какие процессы будут протекать на катоде и аноде? Какое время нужно для проведения рафинирования при токе 500 А для выделения 5 кг никеля при катодном выходе по току 98%?
Ионный состав раствора:
H2SO4 → H+ + SO42-
H2O ↔ H+ + OH- пусть рН=0

 На
аноде: SO42-,
OH-,
Ni,
Zn,
Cu
На
аноде: SO42-,
OH-,
Ni,
Zn,
Cu
Выписываем все потенциалы
Е0Н+/Н2= 0 В (т.к. рН=0)
ЕрО2/ОН- =1,23-0,059рН = +1,23В;
Е0Ni2+/Ni = - 0,25В
Е0Zn2+/Zn = -0,763В;
Е0Сu2+/Cu = + 0,337В
[+A]: Zn0 → Zn2+ + 2е (в первую очередь, т.к. Е0Zn2+/Zn< Е0Ni2+/Ni)
Ni0 → Ni2+ + 2е
Cu не растворяется и выпадает в шлам, а затем ее собирают со дна.
На катоде: сначала H+; затем диффундируют Ni2+; Zn2+
[- K]: 2Н+ + 2е → Н2↑ сначала, пока сNi ≈ 0
Ni2+ + 2е → Ni0 затем преобладающий процесс
ионы Zn2+ остаются в растворе – процесс ведут при контролируемом потенциале > Е0Zn2+/Zn
Так получают очень чистые М.
Время рафинирования:
по закону Фарадея (Мэ,Ni=29,5 г/моль):
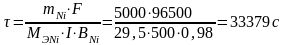 или τ = 9,27 ч
или τ = 9,27 ч
Размерная обработка
Используется для изменения размеров и форм, шлифования, полирования твердых металлов и сплавов.
[+A]: М → Мn+р-р + ne
[- K]: 2Н+р-р + ne → Н2↑
Анодирование
– анодная обработка М и сплавов
Обработка М в специальных электролитах для повышения коррозионной стойкости, износостойкости, создания изолирующих слоев на поверхности.
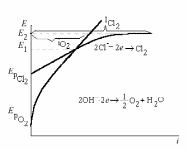
ПРИМЕР. Хлорный электролиз
Определите объем Cl2, выделившийся при электролизе водного раствора NaCl на платиновых электродах, если объем выделившегося при этом Н2 - 44,8 мл. Выход по току хлора – 80%.
Решение. Ионный состав раствора:
NaCl → Na+ + 2Сl-
H2O ↔ H+ + OH-
рН =7 гидролизa соли
Потенциалы возможных процессов:
ЕрН+/Н2 = -0,059рН = -0,41В
ЕрО2/ОН- =1,23-0,059рН = +0,81В;
Е0Сl2/Cl- = + 1,36В
Е0Сl2/Cl- - ЕрО2/ОН- < 1 Þ возможны оба процесса
Электродные процессы:
[- K]: 2Н+ + 2е → Н2↑
[+A]: 4ОН- → О2 ↑ + 2Н2О + 4е
2Cl- → Cl2 + 2e
По закону Фарадея:
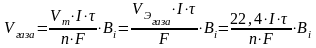
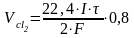
Количество электричества, прошедшее через электроды:
qk = qa = I·τ
 Þ
Þ
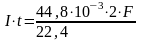
Þ

ЛЕКЦИЯ 21. КОРРОЗИЯ МЕТАЛЛОВ.
К О Р Р О З И Я - самопроизвольное и необратимое разрушение металла под действием компонентов окружающей среды- окислителей В результате коррозии металл – окисляется, теряет электроны, переходит в форму соединения, а окислители из окружающей среды восстанавливаются, забирают электроны у металла.
В общем виде
nM + mOx → MnRedm (1)
Коррозия - процесс
самопроизвольный
Þ
то есть

ΔG (1) < 0 для большинства металлов (ΔG (1) - это энергия Гиббса образования соединения из простых веществ = ΔfGi - см. таблицу).
Þ Металлы встречаются в природе в основном в виде соединений.
Þ Процесс получения металлов из соединений, наоборот, вынужденный, требует затраты энергии.
Убытки человечества от коррозии исчисляются миллиардами рублей, долларов и евро ежегодно( разрушение трубопроводов, цистерн, машин, корпусов судов, морских сооружений и т. п.) Безвозвратные потери металлов составляют более 15% от ежегодного их производства !
Косвенные убытки от коррозии часто значительно превышают прямые потери (выход из строя парового котла, обшивки танкера и пр.).
Экологический аспект
2-я половина прошлого века - создана теория коррозии Þ борьба с ней приняла целенаправленный характер.
КЛАССИФИКАЦИЯ КОРРОЗИИ
- по механизму протекания,
- по условиям протекания,
- по характеру разрушения
по механизму протекания
1. Химическая коррозия протекает в неэлектропроводных средах, как гетерогенная окислительно-восстановительная реакция
2. Электрохимическая коррозия протекает в электропроводящих средах как электрохимическая реакция
Химическая коррозия:
а) газовая или высокотемпературная коррозия (ВТК)
в газах и парах при высоких температурах ;
б) в неэлектролитах агрессивных органических жидкостях,
(например, сернистая нефть и др.)
При химической коррозии происходит прямое взаимодействие металла с
окислителем окружающей среды, непосредственный переход электронов
металла на окислитель. Критерий возможности протекания химической коррозии: ∆ G < 0
Электрохимическая коррозия:
протекает в средах, имеющих ионную проводимость:
в электролитах в водных растворах солей, кислот, щелочей, в морской воде;
в атмосфере любого влажного газа;
в почве, в т.ч. коррозия под действием блуждающего тока.
При электрохимической коррозии на энергетически неоднородной металлической поверхности возникают локальные Г.Э.: участки с более -Е _ оказываются анодами ,на них идет анодное растворение М, а участки с более +Е оказываются катодами, на них идет катодное восстановление окислителя .Процессы разделены пространственно, идут на разных участках поверхности
Отличием коррозионного Г.Э. от обычного является отсутствие внешней цепи,
т.е. К.Г.Э. является короткозамкнутым.от обычного явл.нного Г.Э.ьным Е оказываются анодамиозникают локальные Г.
На анодном участке
А: M
→ Mn+(р)
+ n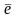
На катодном участке К: Ox + n e = Red
по характеру разрушения поверхности
Общая – примерно равномерное разрушение всей поверхности металла
Местная – пятнами, язвами, точечная (питтинг), сосредоточена на отдельных участках, проникает на большую глубину
Межкристаллитная – разрушение по границам зерен металла (где скапливаются примеси)
Избирательная –растворение одного из компонентов сплава (более активного восстановителя)
По условиям протекания
Коррозия под напряжением (химическое и механическое воздействие) – коррозионное растрескивание (КР)- под действием растягивающих напряжений (нержав. стали – образование транскристаллитных трещин), коррозионная усталость (КУ) - под действием циклических напряжений •Атмосферная• Почвенная и др.
Блуждающими токами (подземные коммуникации, трубопроводы) при недостаточной изоляции рельсов электротранспорта от земли и утечке тока.
Термодинамика и механизм электрохимической коррозии
При электрохимической коррозии:
на анодных участках А : М → Мn+ + n
На катодных участках K : Ox + n → Red .
Один процесс идет за счет другого Þ не может идти без другого. Такие процессы называют сопряженными. Коррозионный Г.Э.работает, пока ЭДС > 0 или Е катода > Е анода
Условие возможности электрохимической коррозии
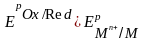
ЕРOx/Red- равновесный потенциал окислителя в данной среде
ЕРMn+/M - равновесный потенциал металла в данной среде

Поверхность М, как правило, энергетически неоднородна. (пятна оксида, красок, недостаточная чистота обработки и др.) Самые распространенные окислители:
а) О2 воздуха,(в том числе растворенный в электролите)
б) ионы Н+ из электролита или молекул H2O.
Уравнения катодных реакций (восстановления окислителей)
коррозия с поглощением кислорода (коррозия с кислородной деполяризацией)
O2 + 4H+ + 4 → 2H2O pH < 7
O2 + 2H2O + 4 → 4OH- pH ³ 7
расчет по уравнению Нернста:
,
Е
= 1,227 + 0,0147 lg –
0,059рН , (часто р
о2=
0,21)
–
0,059рН , (часто р
о2=
0,21)
коррозия с выделением водорода (коррозия с водородной деполяризацией):
2H+ + 2 → H2 pH < 7
2H2O + 2 → H2 + 2OH– pH ³ 7
Расчет по уравнению Нернста:
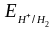 =
– 0,059рН
0,0295 lg
=
– 0,059рН
0,0295 lg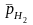 .(часто
рн2
=1)
.(часто
рн2
=1)
Потенциал окислителя можно определить по диаграмме электрохимической устойчивости воды. Приведенная запись анодного процесса полностью его не отражает, т.к. идет и взаимодействие с компонентами среды. Упрощенная схема взаимодействий:
М
Н 2 О ↓ А-
М(ОН)2 ( [М(ОН)3]- ) ← М2+→МА2 ( [ МА3]- )
Расчет по уравнению Нернста сложен. Для определения Е в водных растворах используют диаграммы Пурбэ В ориентировачных расчетах используют Е0.мет.,т.е. для установления термодинамической возможности коррозии металла проверяют соблюдение неравенства:
Е0мет < Еоx
Разные металлы корродируют по-разному, в зависимости от их стандартного потенциала и рН:
а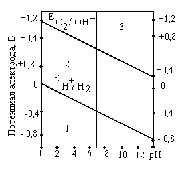 )
если потенциал металла положительнее
потенциала кислородного электрода
(область 3), то коррозия металла невозможна.
Например, золото,
платина не
могут корродировать ни с поглощением
О2
, ни с выделением Н2,
так как Еок
<
)
если потенциал металла положительнее
потенциала кислородного электрода
(область 3), то коррозия металла невозможна.
Например, золото,
платина не
могут корродировать ни с поглощением
О2
, ни с выделением Н2,
так как Еок
<
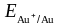 .
.
б) если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода (область 2), то коррозия возможна с поглощением кислорода и невозможна с выделением водорода, например:
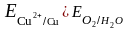 и
и
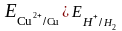
в) если потенциал металла отрицательнее потенциала водородного электрода, то возможна коррозия как с поглощением кислорода, так и с выделением водорода (область 1): (щелочные, щелочно-земельные металлы, магний, алюминий, цинк и др. цветные металлы.)
ПРИМЕР. Влияние рН среды на коррозию железа Fe с примесями меди Cu. (Пусть рН = 3(кислая) и 10 (основная)).
Сравниваем потенциалы металлов (основного и примесей, компонентов сплава, основного металла и покрытия и т.д.). Разрушаться (окисляться) будет металл с более отрицательным потенциалом (более сильный восстановитель).
Здесь - сравниваем стандартные потенциалы:
ЕоFe2+/Fe < ЕоCu2+/CuÞ (A): Fe → Fe2+ + 2
- 0,44 < + 0,34
2. Определяем равновесные потенциалы окислителей в
заданной среде
рН = 3 рН = 10
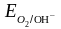 ≈
1,23 – 0,059рН ≈ 1,05В
≈
1,23 – 0,059рН ≈ 0,64В
≈
1,23 – 0,059рН ≈ 1,05В
≈
1,23 – 0,059рН ≈ 0,64В
≈ – 0,059рН ≈ -0,18В ≈ – 0,059рН ≈ -0,59В
3) Сравниваем значения потенциалов окислителей и металла, делаем вывод о возможности данного процесса коррозии
рН = 3
- 0,44 < 1,05 Þ возможна коррозия с поглощением кислорода
- 0,44 < -0,18 Þвозможна коррозия с выделением водорода
рН = 10
- 0,44 < 0,64 Þвозможна коррозия с поглощением кислорода
- 0,44 > -0,59 Þневозможна коррозия с выделением водорода
4) Записываем уравнения коррозионных процессов на К:
рН = 3 рН = 10
(К): 2H+ + 2 → H2
O2 + 4H+ + 4 → 2H2O O2 + 2H2O + 4 → 4OH-
есть синее окрашивание нет синего окрашивания
→ пассивация Fe: Fe(OH )2
K3[Fe(CN)6] качественный реагент на ионы Fe2+
2 K3[Fe(CN)6] +3 Fe2+ = Fe3[Fe(CN)6]2 + 6 K+
синий цвет – «турнбулева синь».
Атмосферная коррозия
Атмосферная – коррозия М в атмосферных условиях.Первопричина – увлажнение и загрязнение поверхности М. Загрязнители( газы SO2, СО,СО2,NOx…) растворяются во влажной пленке на М:
СО2 + Н2 О ↔ Н2СО3↔Н+ + НСО3-( рН падает ,Соx увеличивается).
Рассмотрим Fe c примесями Cu в атмосферных условиях:
А: Fe → Fe2+ + 2e
K: 2Н+ +2e→H2
O2 +4H++4e→2H2O
Дальнейшие превращения металла зависят от рН пленки, природы и С загрязнителей. Экспериментально установлено, что в атмосферных условиях на Fe образуется рыхлые слои оксидов:Fe2O3 • FeO ; FeOOH+.Анодная реакция идет на поверхности М, катодная – на границе оксидных слоев. В каналах – продукты коррозии (соли М, в основном сульфаты, которые электропроводность и V коррозии повышается). Аналогично протекает атмосферная коррозия у др.металлов:
М: Pb Al Sn Cu Ni Zn Fe
V,мкм/год
4 8 12 12 32 50 200
Vатм.корр.= f ( природы М, влажности, природы и С загрязнителей, рН пленки на М)
