
- •Лекция 1. Основные понятия и законы Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
- •Лекция 2. Строение атома
- •Ядро электронная оболочка
- •Уравнение де Бройля:
- •Число подуровней Подуровни
- •Лекция 2. Периодическая система элемнтов д.И. Менделеева
- •Валентные свойства атомов
- •Характер изменения свойств атомов и образованных ими простых соединений
- •Лекция 4. Химическая связь
- •3 Связи: σ- и две π – связи, механизм образования - обменный
- •Лекция 5. Метод валентных связей
- •Лекция 6. Взаимодействия между молекулами
- •Силы Ван-дер-Ваальса
- •Индукционная составляющая – электростатическое взаимодействие полярной и неполярной молекул или неполярной молекулы с внешним электростатическим полем.
- •Едисп увеличивается:
- •С увеличением поляризуемости молекул (атомов)
- •С уменьшением расстояния между частицами
- •Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
- •Лекция 8. Энергетика химических процессов
- •С (графит) 5,74 8,54
- •С (графит) 298 – 2300 к
- •Искомая область температур: 982 ÷ 2300 к
- •Лекция 11. Химическое равновесие
- •Лекция 12. Основные понятия химической кинетики
- •Влияние концентрации на скорость реакции
- •Лекция 13. Основы кинетики сложных и гетерогенных реакций
- •Лекция 14. Дисперсные системы и общие понятия о растворах Растворы
- •2. Газообразные: (газовые смеси) Воздух: о2, n2, Ar, н2о (пары)
- •Жидкие растворы
- •Растворы электролитов Растворы неэлектролитов
- •Способы выражения концентрации растворов.
- •Термодинамика процесса растворения
- •Основные стадии процесса растворения:
- •Законы идеальных растворов
- •Осмотическое давление
- •Закон Вант - Гоффа
- •Реальные растворы. Активность.
- •Лекция № 15. Растворы электролитов
- •Ступенчатая диссоциация
- •Расчет рН слабых кислот и оснований
- •Расчет рН сильных кислот и оснований
- •4 Типа солей
- •2) Соли, образованные слабым основанием и сильной кислотой
- •3) Соли, образованные сильным основанием и слабой кислотой
- •4) Соли, образованные слабым основанием и слабой кислотой
- •Гетерогенные равновесия врастворах малорастворимых сильных электролитов
- •Равновесие в растворах комплексных соединений
- •Лекция 17. Окислительно-восстановительные иэлектрохимические процессы
- •Лекция 18. Гальванический элемент
- •Компенсационным методом с помощью переменной внешней эдс
- •Лекция № 20. Электролиз
- •Электроды
- •В случае электролиза раствора Na2so4 (электроды Pt)
- •В случае электролиза раствора NaCl (электроды Pt)
- •Лекция 22. Скорость электрохимической коррозии.
- •Лекция 24. Химическая коррозия металлов
- •Лекция 25. Защита металлов от химической коррозии
- •Лекция 26. Определение возможности коррозии и надежности выбранного метода защиты металла на конкретных примерах
Гетерогенные равновесия врастворах малорастворимых сильных электролитов
Ag+ + Cl- → AgCl↓
В насыщенных растворах сильных электролитов
- равновесие между твердой фазой и
ионами в р - ре:
насыщенных растворах сильных электролитов
- равновесие между твердой фазой и
ионами в р - ре:
АgCl(тв) Ag+(p-р) + Cl-(p-р)
- гетерогенный процесс
Соли – сильные электролиты Þ та часть соли, которая растворилась полностью диссоциирована на ионы:
АgCl(тв) → Ag+(p-р) + Cl-(p-р)
сР сР сР моль/л
Растворимость CР - концентрация насыщенного раствора электролита при данной Т
Для гетерогенного процесса:
 ,
,
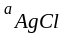 = 1 ( тв. вещество) Þ
= 1 ( тв. вещество) Þ
Кравн
=
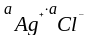 = ПР
= ПР
ПР – произведение растворимости:
произведение а ионов, содержащихся в насыщенном растворе электролита, в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при Т = const
В общем виде:
АnBm(т) n Am+(н.p) + m Bn-(н.p)

ПР зависит от природы электролита и растворителя, T
не зависит от а ионов
ПР 25 С – табулированы
Условие образования осадка:
Если
(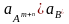 )
³
ПРтабл
– осадок выпадает
)
³
ПРтабл
– осадок выпадает
Если ( ) < ПРтабл – осадок не выпадает
ЗАДАЧА. Можно ли приготовить раствор Са(ОН)2 концентрации с = 2.10-3 моль/л? ПР Са(ОН)2 = 6.10-6
Решение.
Ионная сила раствора:
I = ½(cCa2+∙ z2Ca2+ + cOH- ∙ z2OH-) = 8.10-3
коэффициенты активности (из таблицы):
gСа2+ ≈ 0,61 gОН- ≈ 0,93
ПА в растворе требуемой концентрации:
ПА = аСа2+∙ (аОН-)2 = 0,61.2.10-3∙(0,93.4.10-3)2 = 1,69.10-8
ПА < ПРтабл Þ раствор заданной С можно приготовить.
Зная ПР, можно рассчитать растворимость сР [моль/л], [ г/л],[г/моль] и наоборот
АnBm(т) n Am+(н.p) + m Bn-(н.р)
сР nсР mсР моль/л
ПР = = (gА m+×n ×сР)n × (gB n-×m ×сР)m= (gА m+)n ×(gB n-)m × nn × mm ×(сР)n+m
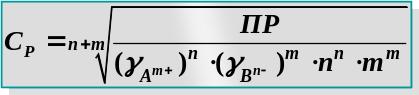
– растворимость труднорастворимого сильного электролита
если g ® 1

ЗАДАЧА. Определите сР MgF2 . ПР(MgF2) = 4×10-9
Решение:
MgF2 (т) Mg2+(н.р) + 2F-(н.р)
Значение ПР мало, g ® 1, aBa2+ » [Ba2+] и aF- » [F–].
ПР(MgF2)
= 4×10-9
=
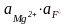 n
=2, m=1
n
=2, m=1
сР
=
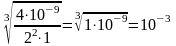 моль/л
моль/л
Равновесие в растворах комплексных соединений
Комплексные соединения диссоциируют в водных растворах как сильные электролиты на внешнюю и внутреннюю сферы (комплексы).
Комплексы, или комплексные ионы, диссоциируют, в свою очередь, как слабые электролиты, причем диссоциация их происходит ступенчато путем последовательного отщепления лигандов.
Константа суммарной реакции диссоциации комплекса КН называется константой нестойкости и равна произведению констант диссоциации по отдельным ступеням. В общем виде для диссоциации комплекса:
МХnz Мn+ + nXm
г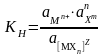 де
z
заряд комплекса; n+
заряд комплексообразователя; m
заряд лиганда.
де
z
заряд комплекса; n+
заряд комплексообразователя; m
заряд лиганда.
Значения констант нестойкости некоторых комплексных ионов табулированы.
Константа процесса, обратного диссоциации комплекса, т. е. процесса образования комплекса, называется константой устойчивости комплекса: КУ = 1/КН.
Задача. Рассчитайте концентрацию ионов Cu2+ в 0.05 М растворе [Cu(NH3)4]SO4 а) в отсутствие избытка лиганда и б) при наличии избытка аммиака концентрации 1 моль/л.
Решение. а) В соответствии с уравнением диссоциации комплексной соли как сильного электролита:
[Cu(NH3)4]SO4 [Cu(NH3)4]2+ + SO42-
концентрация комплексного иона в растворе составит 0,05 моль/л. Константа нестойкости комплексного иона [Cu(NH3)4]2+ для суммарной диссоциации равна 2,14.10-13.
Обозначим через х концентрацию Cu2+. Тогда в соответствии с уравнением суммарной диссоциации
[Cu(NH3)4]2+ Cu2+ + + 4NH3 ,
равновесная концентрация аммиака [NH3] равна 4х, а концентрация недиссоциированного комплексного иона равна (0,05 – х). Поскольку значение КН очень мало, величиной х по сравнению с 0,05 можно пренебречь. С учетом этого запишем выражение для КН : КН =[Cu2+][NH3]4/[Cu(NH3)4]2+ = =x(4x)4/0,05 = 2,14.10-13. Откуда х = [Cu2+]= 5,3.10-4 моль/л.
б) Концентрацию ионов Cu2+ рассчитываем аналогично, только принимаем [NH3] = 1 моль/л: КН = х.1/0,05 = 2,14.10-13. Откуда х = 1,07.10-14 моль/л.
Таким образом, в децимолярном растворе аммиака концентрация свободных ионов меди будет более чем на 10 порядков ниже, чем в воде.
Задача. Разрушиться ли комплекс [Ag(NH3)2]+ , концентрация которого в растворе составляет 0,1 моль/л, при добавлении раствора NaCl такой же концентрации? (Изменение объема не учитывать).
Решение. Найдем концентрацию свободного иона Ag+ как в примере 15, учитывая, что табличное значение Кн=1.10-8. [Ag+]=6,3.10-4 . ПР(AgCl) = 1.10-10. ПК = [Ag+][Cl-] = 6,3.10-4. 10-1 = 6,3.10-5 > ПР. Следовательно, выпадет осадок AgCl, равновесие диссоциации комплекса
[Ag(NH3)2]+ Cu2++ 4NH3
сместится вправо, в сторону усиления диссоциации и комплекс разрушится.
