
- •Лекция 1. Основные понятия и законы Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
- •Лекция 2. Строение атома
- •Ядро электронная оболочка
- •Уравнение де Бройля:
- •Число подуровней Подуровни
- •Лекция 2. Периодическая система элемнтов д.И. Менделеева
- •Валентные свойства атомов
- •Характер изменения свойств атомов и образованных ими простых соединений
- •Лекция 4. Химическая связь
- •3 Связи: σ- и две π – связи, механизм образования - обменный
- •Лекция 5. Метод валентных связей
- •Лекция 6. Взаимодействия между молекулами
- •Силы Ван-дер-Ваальса
- •Индукционная составляющая – электростатическое взаимодействие полярной и неполярной молекул или неполярной молекулы с внешним электростатическим полем.
- •Едисп увеличивается:
- •С увеличением поляризуемости молекул (атомов)
- •С уменьшением расстояния между частицами
- •Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
- •Лекция 8. Энергетика химических процессов
- •С (графит) 5,74 8,54
- •С (графит) 298 – 2300 к
- •Искомая область температур: 982 ÷ 2300 к
- •Лекция 11. Химическое равновесие
- •Лекция 12. Основные понятия химической кинетики
- •Влияние концентрации на скорость реакции
- •Лекция 13. Основы кинетики сложных и гетерогенных реакций
- •Лекция 14. Дисперсные системы и общие понятия о растворах Растворы
- •2. Газообразные: (газовые смеси) Воздух: о2, n2, Ar, н2о (пары)
- •Жидкие растворы
- •Растворы электролитов Растворы неэлектролитов
- •Способы выражения концентрации растворов.
- •Термодинамика процесса растворения
- •Основные стадии процесса растворения:
- •Законы идеальных растворов
- •Осмотическое давление
- •Закон Вант - Гоффа
- •Реальные растворы. Активность.
- •Лекция № 15. Растворы электролитов
- •Ступенчатая диссоциация
- •Расчет рН слабых кислот и оснований
- •Расчет рН сильных кислот и оснований
- •4 Типа солей
- •2) Соли, образованные слабым основанием и сильной кислотой
- •3) Соли, образованные сильным основанием и слабой кислотой
- •4) Соли, образованные слабым основанием и слабой кислотой
- •Гетерогенные равновесия врастворах малорастворимых сильных электролитов
- •Равновесие в растворах комплексных соединений
- •Лекция 17. Окислительно-восстановительные иэлектрохимические процессы
- •Лекция 18. Гальванический элемент
- •Компенсационным методом с помощью переменной внешней эдс
- •Лекция № 20. Электролиз
- •Электроды
- •В случае электролиза раствора Na2so4 (электроды Pt)
- •В случае электролиза раствора NaCl (электроды Pt)
- •Лекция 22. Скорость электрохимической коррозии.
- •Лекция 24. Химическая коррозия металлов
- •Лекция 25. Защита металлов от химической коррозии
- •Лекция 26. Определение возможности коррозии и надежности выбранного метода защиты металла на конкретных примерах
3) Соли, образованные сильным основанием и слабой кислотой
– гидролиз по аниону
(К2SiO3, Na2S, Ba(СН3СОО)2 и т. п.)
Диссоциация соли: Na2S ® 2Na+ + S2-
NaOH H2S
сильное основание слабая кислота
Гидролиз – по слабому иону:
I cт.: S2- + HOН HS- + ОН-
Н+ОН-
щелочная среда, рН > 7
II ст.: HS- + HOН H2S + ОН- рН ↑
4) Соли, образованные слабым основанием и слабой кислотой
– гидролиз по катиону и аниону
(NН4СN, РbCO3, Аl2S3 и т. п.)
Диссоциация соли: NН4СN → NН4+ + CN-
NH4ОН HCN
слабое основание слабая кислота
Гидролиз – по слабым ионам:
NН4+ + СN- + Н2О NН4ОН + НСN
Н+ОН-
Растворы таких солей могут быть кислыми, нейтральными или щелочными в зависимости от соотношения КД слабых электролитов, образующихся при гидролизе.
КД NH4OH = 1,8 ∙ 10 -5 , КД HCN = 7,9 ∙ 10 -10
КД NH4OH ˃ КД HCN Þ рН > 7, слабощелочная среда
Количественная характеристика гидролиза - степень гидролиза b-
- отношение концентрации гидролизованных ионов соли к исходной концентрации соли

b £ 1 аиона ≈ сиона
Гидролиз – обратимый равновесный процесс:
NH4+ + НОН NH4ОН + Н+
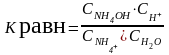
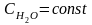
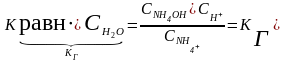 - константа
гидролиза
- константа
гидролиза
х числитель и знаменатель на СОН-

 КW
КW

КД NH4OH
Þ
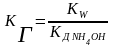
В общем случае:
КГ иона соли по определенной ступени равна ионному произведению воды, деленному на КД слабого электролита, образующегося на данной ступени гидролиза.
Диссоциация: Na2S ® 2Na+ + S2-
Гидролиз:
I cт. S2- + HOН HS- + ОН-
II ст. HS- + HOН H2S + ОН-
Выражения КГ через равновесные С ионов:
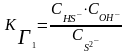
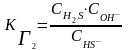
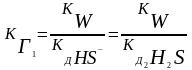
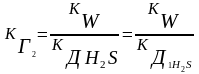
Диссоциация H2S:
I ст. H2S HS- +Н+
II ст. HS- S2- + Н+
КГ1=10-14/10-14 = 1 КГ2=10-14/1,1.10-7 = 9,1.10-8
КГ1 >> КГ2 (всегда) Þ
все количественные расчеты по I ступени !
Для
соли, образованной слабой
кислотой и слабым
основании
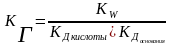
Чем ↓ КД продукта гидролиза, тем ↑ КГ
КГ зависит:
от Т (сильно), с ↑ Т ↑КГ (DНГ < 0)
от природы гидролизующегося иона
не зависит от концентрации
Связь между b и КГ (аналогично закону Оствальда):

Если
<< 1
![]()

Расчет рН растворов солей с гидролизом по аниону:
ЗАДАЧА.
Рассчитайте КГ, b и рН 0,01 М раствора К2SО3.
Решение.
Диссоциация сильного электролита К2SО3:
со 2со со
К2SО3 ® 2К+ + SО32-
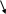
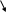
КОН Н2SО3
сильное основание слабая кислота
Гидролиз по SО32- (слабый ион):
I ст.: SО32-+ НОН НSО3-+ ОН- щелочная среда
с равн: c0 - х х х
I
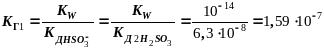 I
ст.: НSО3-
+ Н2О
Н2SО3
+ ОН-
I
ст.: НSО3-
+ Н2О
Н2SО3
+ ОН-
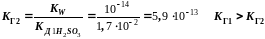
Þ расчет по I ступени гидролиза
I способ - через материальный баланс:
SО32-+ НОН НSО3-+ ОН-
|
SO32- |
НSO3- |
OН- |
cисход |
со |
0 |
0 |
Dc |
x |
x |
x |
cравн |
со - x |
x |
x |
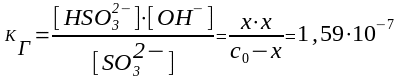
Þ x = [ОН-] = 4×10-5 моль/л
pOH = -lg[ОН-] = 4,4 pH = 14 - 4,4 = 9,6
II способ - через степень гидролиза:
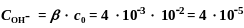
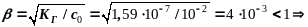 рОН
= - lgCOH-
= -lg
4 ∙ 10 -5 =
4,4
рОН
= - lgCOH-
= -lg
4 ∙ 10 -5 =
4,4
рН = 14 – рОН = 14 – 4,4 = 9,6 рН ˃ 7
Расчет рН растворов солей с гидролизом по катиону:
ЗАДАЧА. Рассчитайте рН 0.5 М раствора АlСl3, учитывая только 1-ю ступень гидролиза.
Решение.
со со 3со
Диссоциация соли: АlСl3 ® Аl3+ + 3Сl-
Al(ОН) 3 НCl
слабое основание сильная кислота
Гидролиз по Аl3+ (слабый ион):
I ст. Аl3+ + Н2О АlОН2+ + Н+ кислая среда
с равн: c0 - х х х

КГ очень мало (<10-4) Þ
b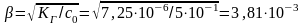 <<
1 Þ
расчет по приближенной формуле правомерен
<<
1 Þ
расчет по приближенной формуле правомерен
[H+] = [AlOH2+] = bc0 = 3,81×10-3×0,5 = 1,91×10-3.
Þ рН = – lg [H+] = – lg 1,91×10-3 = 2,6. рН < 7
