
- •Лекция 1. Основные понятия и законы Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
- •Лекция 2. Строение атома
- •Ядро электронная оболочка
- •Уравнение де Бройля:
- •Число подуровней Подуровни
- •Лекция 2. Периодическая система элемнтов д.И. Менделеева
- •Валентные свойства атомов
- •Характер изменения свойств атомов и образованных ими простых соединений
- •Лекция 4. Химическая связь
- •3 Связи: σ- и две π – связи, механизм образования - обменный
- •Лекция 5. Метод валентных связей
- •Лекция 6. Взаимодействия между молекулами
- •Силы Ван-дер-Ваальса
- •Индукционная составляющая – электростатическое взаимодействие полярной и неполярной молекул или неполярной молекулы с внешним электростатическим полем.
- •Едисп увеличивается:
- •С увеличением поляризуемости молекул (атомов)
- •С уменьшением расстояния между частицами
- •Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
- •Лекция 8. Энергетика химических процессов
- •С (графит) 5,74 8,54
- •С (графит) 298 – 2300 к
- •Искомая область температур: 982 ÷ 2300 к
- •Лекция 11. Химическое равновесие
- •Лекция 12. Основные понятия химической кинетики
- •Влияние концентрации на скорость реакции
- •Лекция 13. Основы кинетики сложных и гетерогенных реакций
- •Лекция 14. Дисперсные системы и общие понятия о растворах Растворы
- •2. Газообразные: (газовые смеси) Воздух: о2, n2, Ar, н2о (пары)
- •Жидкие растворы
- •Растворы электролитов Растворы неэлектролитов
- •Способы выражения концентрации растворов.
- •Термодинамика процесса растворения
- •Основные стадии процесса растворения:
- •Законы идеальных растворов
- •Осмотическое давление
- •Закон Вант - Гоффа
- •Реальные растворы. Активность.
- •Лекция № 15. Растворы электролитов
- •Ступенчатая диссоциация
- •Расчет рН слабых кислот и оснований
- •Расчет рН сильных кислот и оснований
- •4 Типа солей
- •2) Соли, образованные слабым основанием и сильной кислотой
- •3) Соли, образованные сильным основанием и слабой кислотой
- •4) Соли, образованные слабым основанием и слабой кислотой
- •Гетерогенные равновесия врастворах малорастворимых сильных электролитов
- •Равновесие в растворах комплексных соединений
- •Лекция 17. Окислительно-восстановительные иэлектрохимические процессы
- •Лекция 18. Гальванический элемент
- •Компенсационным методом с помощью переменной внешней эдс
- •Лекция № 20. Электролиз
- •Электроды
- •В случае электролиза раствора Na2so4 (электроды Pt)
- •В случае электролиза раствора NaCl (электроды Pt)
- •Лекция 22. Скорость электрохимической коррозии.
- •Лекция 24. Химическая коррозия металлов
- •Лекция 25. Защита металлов от химической коррозии
- •Лекция 26. Определение возможности коррозии и надежности выбранного метода защиты металла на конкретных примерах
Расчет рН слабых кислот и оснований
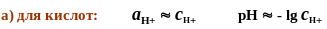
![]()
рН
= - lg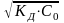
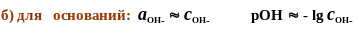
![]()
Расчет рН сильных кислот и оснований
а) для кислот:
Iр-ра = 0,5 × å (сi × z2i ) Þ gН+ (по таблице или формуле)
Þ аН+ = gН+ × сН+ Þ рН = -lg аН+
б) для оснований:
Iр-ра = 0,5 × å (сi × z2i ) Þ gOН- (по таблице или формуле) Þ аОН- = gОН-× сОН- Þ рН = 14 + lg аОН-
рН = 14 - рОН =14 + lg аОН- = 14 + lg gОН-.сОН-
ЗАДАЧА
Рассчитайте рН 0,05 М раствора НСN.
Решение.
НСN Н+ + СN
слабая кислота, со = 0,05 моль/л, КД = 7,91010 (из таблицы)
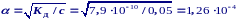
a < 0,07 расчет по упрощенной формуле:
сH+ = со = 1,261040,05 = 6,3106 моль/л
рН = ‑lg сH+ = - lg 6,3106 = 5,18.
ЗАДАЧА
Рассчитайте концентрацию азотистой кислоты НNО2 в растворе с рН = 2,7.
Решение.
НNО2 Н+ + NО2.
слабый электролит, КД = 4,6104
рН = 2,7 при равновесии
[H+] = [NO2 –] = 102,7 моль/л, [HNO2] = (со - 102,7) моль/л
КД HNO2 = [H+] [NO2–]/ [HNO2]
4,6104 = 102,7102,7 / (со – 102,7)
со =0,00214 моль/л.
ЗАДАЧА. Рассчитайте, как изменится рН 0,05 М раствора КОН при введении в него 0,05 моль/л КCl.
Решение.
1) Расчет рН раствора чистой щелочи.
Сильный электролит:
КОН К+ + ОН
с, моль/л: 0,05 0,05 0,05
I= 1/2(0,0512 + 0,0512) = 0,05,
= 0,85 (по табл. или формуле).
аОН- = ОН-∙ сOH- = 0,850,05 = 0,043
рОН = – lg аОН- = – lg 0,043 = 1,37.
рН = 14 – 1,37 = 12,63.
2) Расчет рН после добавления соли.
Соль – сильный электролит:
КСl К+ + Сl
с, моль/л: 0,05 0,05 0,05
I = 1/2сi∙zi2 = 1/2 ( сОН-zOH-2+cNa+zNa+2+cCl-zCl-2+cK+zK+2) = 0,1.
ОН- = 0,8, рОН = – lg 0,80,05 = – lg 0,04 = 1,4.
рН = 14 – 1,4 = 12,6.
! аОН-↓ рН ↓ с 12,63 до 12,6.
ЗАДАЧА. Рассчитайте концентрацию основания Ва(ОН)2 в растворе с рН = 11,3; ОН- = 0,965.
Решение. Ва(ОН)2 - щелочь, сильный электролит:
Ва(ОН)2 Ва2+ + 2ОН
с, моль/л: со со 2со
рОН = 14 - 11,3 = 2,7 аОН- = 102,7 моль/л.
аОН- = ОН--∙ сOH- сOH- = 102,7/0,965 = 0,002 моль/л.
с(Ba(OH)2)= сOH- /2 = 0,002/2 = 0,001 моль/л.
ЛЕКЦИЯ № 16. РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
ГИДРОЛИЗ СОЛЕЙ
- реакции обмена между молекулами воды и ионами соли с образованием слабых электролитов.
Процесс гидролиза:
обратный реакции нейтрализации
эндотермический, ΔНГ>0 (всегда)
в большинстве случаев – обратим
сопровождается изменением рН раствора соли
4 Типа солей
Соли, образованные сильным основанием и сильной кислотой
(Na2SO4, KI, NaВr, СsCl, RbNО3 и т. п.)
- гидролизу не подвергаются
Na2SO4 ® Na+ + SO42-
NaOH H2SO4
сильное основание сильная кислота
среда нейтральная: рН = 7
2) Соли, образованные слабым основанием и сильной кислотой
– гидролиз по катиону
(NH4Cl, AgNO3, AlBr3, CuSO4 и т. п.)
Диссоциация соли: NH4Cl ® NH4+ + Cl–
NH4ОН HCl
слабое основание сильная кислота
Гидролиз – по слабому иону:
NH4+ + НОН NH4ОН + Н+
Н+ОН- кислая среда, рН < 7
Гидролиз многозарядных ионов протекает ступенчато:
Диссоциация соли: Zn(NO3)2 ® Zn2+ + NO3–
Zn(ОН)2 HNO3
слабое основание сильная кислота
Гидролиз – по слабому иону:
I ступень гидролиза: Zn2+ + НОН ZnОН+ + Н+
Н+ОН-
 кислая
среда, рН < 7
кислая
среда, рН < 7
! Раствор – электронейтральная система:
зарядность в левой и правой частях уравнения одинакова
В обычных условиях (Т комн, не слишком разбавленный раствор) гидролиз идет только по I ступени
Усилить гидролиз (сместить гидролитическое равновесие →)
можно:
разбавлением (↑С Н2О)
↑ Т (эндотермическая реакция, ΔНГ > 0)
удалением продуктов гидролиза из сферы реакции (связывание ионов Н+ и ОН- )
СN- + НОН НСN + ОН-
НСl ® Cl- + H+
Н+ + ОН- Н2О
II ступень гидролиза: ZnОН+ + НОН → Zn(ОН)2 ↓+ Н+
кислая среда, рН ↓
Если в результате гидролиза образуются малорастворимые или газообразные вещества Þ гидролиз необратимый
