
- •Лекция 1. Основные понятия и законы Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
- •Лекция 2. Строение атома
- •Ядро электронная оболочка
- •Уравнение де Бройля:
- •Число подуровней Подуровни
- •Лекция 2. Периодическая система элемнтов д.И. Менделеева
- •Валентные свойства атомов
- •Характер изменения свойств атомов и образованных ими простых соединений
- •Лекция 4. Химическая связь
- •3 Связи: σ- и две π – связи, механизм образования - обменный
- •Лекция 5. Метод валентных связей
- •Лекция 6. Взаимодействия между молекулами
- •Силы Ван-дер-Ваальса
- •Индукционная составляющая – электростатическое взаимодействие полярной и неполярной молекул или неполярной молекулы с внешним электростатическим полем.
- •Едисп увеличивается:
- •С увеличением поляризуемости молекул (атомов)
- •С уменьшением расстояния между частицами
- •Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
- •Лекция 8. Энергетика химических процессов
- •С (графит) 5,74 8,54
- •С (графит) 298 – 2300 к
- •Искомая область температур: 982 ÷ 2300 к
- •Лекция 11. Химическое равновесие
- •Лекция 12. Основные понятия химической кинетики
- •Влияние концентрации на скорость реакции
- •Лекция 13. Основы кинетики сложных и гетерогенных реакций
- •Лекция 14. Дисперсные системы и общие понятия о растворах Растворы
- •2. Газообразные: (газовые смеси) Воздух: о2, n2, Ar, н2о (пары)
- •Жидкие растворы
- •Растворы электролитов Растворы неэлектролитов
- •Способы выражения концентрации растворов.
- •Термодинамика процесса растворения
- •Основные стадии процесса растворения:
- •Законы идеальных растворов
- •Осмотическое давление
- •Закон Вант - Гоффа
- •Реальные растворы. Активность.
- •Лекция № 15. Растворы электролитов
- •Ступенчатая диссоциация
- •Расчет рН слабых кислот и оснований
- •Расчет рН сильных кислот и оснований
- •4 Типа солей
- •2) Соли, образованные слабым основанием и сильной кислотой
- •3) Соли, образованные сильным основанием и слабой кислотой
- •4) Соли, образованные слабым основанием и слабой кислотой
- •Гетерогенные равновесия врастворах малорастворимых сильных электролитов
- •Равновесие в растворах комплексных соединений
- •Лекция 17. Окислительно-восстановительные иэлектрохимические процессы
- •Лекция 18. Гальванический элемент
- •Компенсационным методом с помощью переменной внешней эдс
- •Лекция № 20. Электролиз
- •Электроды
- •В случае электролиза раствора Na2so4 (электроды Pt)
- •В случае электролиза раствора NaCl (электроды Pt)
- •Лекция 22. Скорость электрохимической коррозии.
- •Лекция 24. Химическая коррозия металлов
- •Лекция 25. Защита металлов от химической коррозии
- •Лекция 26. Определение возможности коррозии и надежности выбранного метода защиты металла на конкретных примерах
Осмотическое давление
Осмос - односторонняя диффузия растворителя в раствор с большей концентрацией, возникающая в растворах при наличии полупроницаемой перегородки (мембраны), которая пропускает молекулы растворителя и не пропускает частицы растворенного вещества

Молекулы растворителя диффундируют из растворителя в раствор из менее концентрированного раствора в более концентрированный, поэтому концентрированный раствор разбавляется, при этом увеличивается и высота его столба.
Осмотическое давление (Р осм) - минимальное давление, которое нужно приложить к раствору, чтобы осмос не происходил
При достижении равновесия Р осм = давлению столба раствора в осмометре
Закон Вант - Гоффа
Р осм разбавленного раствора неэлектролита не зависит от природы компонентов раствора ие возрастает с ↑ концентрации и температуры
Р осм = сRT
Р осм, [кПа], с, [моль/л], T [K], R = 8,3 Дж/(моль∙ К)
ЗАДАЧА. При 18 ºС осмотическое давление раствора глицерина равно 3,039 · 105 Па. Каково будет Р осм, если раствор разбавить в 3 раза, а Т повысить до 37 º С?
Решение.
В соответствие с уравнением Вант-Гоффа:
концентрация раствора С1 до разбавления:
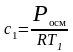 .
.
осмотическое давление раствора Р'осм. после разбавления и повышения Т:
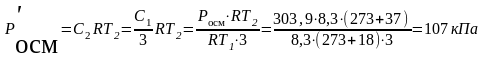
Реальные растворы. Активность.
концентрация раствора Þ отклонения от законов идеальных растворов вследствие взаимодействия между частицами раствора.
Вместо концентрации (с) – активность (а).
а = g∙с
g – коэффициент активности, учитывает все виды взаимодействия частиц в растворе:
вычисляют по экспериментальным данным (Тзам, Ткип и др.)
рассчитывают теоретически
Лекция № 15. Растворы электролитов
Электролиты – вещества с ионной или ковалентной полярной связью: диссоциирующие в Н2О, др. полярных растворителях или расплавах на ионы и способные проводить электрический ток
Растворы, расплавы электролитов – ионные проводники (II рода):
перенос тока в осуществляется ионами
Металлические проводники (I рода): е-- проводимость
Распад вещества на ионы - электролитическая диссоциация:
результат взаимодействия частиц растворяющегося вещества с молекулами растворителя + тепловое (колебательное) движение частиц
сопровождается образованием сольватированных ионов
(если растворитель Н2О – ионы гидратированные)
Диссоциация NaCl
ЭО(Cl) = 3,0 ЭО(Na) = 0,9 ∆ЭО = 2,1 Þ ионная связь
ион – дипольное взаимодействие
NaClк + H2O ® Na+ × aq + Cl– × aq
гидратированные ионы

NaCl ® Na+ + Cl–
Диссоциация НCl
ЭО(Cl) = 3,0 ЭО(Н) = 2,1 ∆ЭО = 0,9 Þ ковалентная полярная связь
диполь – дипольное взаимодействие
НCl + H2O ® Н+ × aq + Cl– × aq
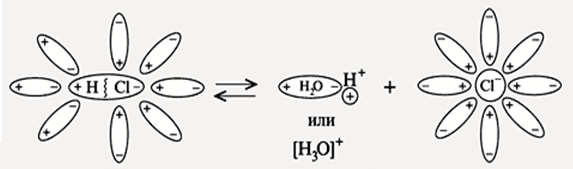
НCl ® Н+ + Cl–
Количественная характеристика диссоциации -
степень диссоциации a:
отношение числа молекул, диссоциированных на ионы (сдис), к общему числу молекул электролита (со)
a = сдис / со
a = 0 – неэлектролиты, сдис = 0
a ≈ 1 – сильные электролиты сдис ≈ с0
a << 1 - слабые электролиты сдис < с0 (a: 0,03 ÷ 03)
a зависит:
от природы растворенного вещества
(от строения молекул, химической связи в них, межмолекулярных взаимодействий)
Вещество, с = соnst |
lсв, нм |
Есв, кДж/моль |
a |
HF |
0,92 |
536 |
0,10 |
HCl |
1,27 |
432 |
0,92 |
HBr |
1,40 |
360 |
0,95 |
HI |
1,60 |
299 |
0,98 |
↑ lсв, Есв ↓, a ↑
H+ᵟ — F-ᵟ ∙ ∙ ∙ H+ᵟ — F-ᵟ ∙ ∙ ∙ H+ᵟ — F-ᵟ (Н – связи)
от природы растворителя (величины диэлектрической проницаемости среды ε)
HCl
-
растворитель
ε
a
Н2О
80,4
0,92
С6Н6
2,3
≈ 0
! Четкой границы между сильными и слабыми электролитами нет
от температуры
сильные электролиты: с ↑ Т a↓
слабые электролиты: зависимость проходит через максимум (для многих веществ max находится в области 60 0С)
от концентрации
В водных растворах
Сильные электролиты:
кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO4 и др.
2. щелочи (гидроксиды s-металлов, кроме Be(OH)2 Mg(OH)2)
почти все соли
Слабые электролиты:
многие неорганические и органические кислоты
основания р-, d- элементов, Be(OH)2, Mg(OH)2) (справочник)
NH4OH, амины
H2O
СЛАБЫЕ ЭЛЕКТРОЛИТЫ
Процесс диссоциации – обратим
Равновесие в растворе слабого электролита характеризуется константой диссоциации
Диссоциация
слабой кислоты:
НА
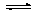 Н+
+ А-
Н+
+ А-
Диссоциации
слабого основания:
RОН
 R+
+ ОН–
R+
+ ОН–
КД зависит от:
природы диссоциирующего вещества и растворителя;
температуры:
С Т Þ КД , т. к. DНдисс> 0
КД – не зависит от концентрации раствора
К25д Þ таблица
Чем ↓ КД, тем слабее диссоциирует электролит
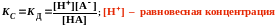
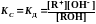
ЗАВИСИМОСТЬ a от С слабого электролита
муравьиная кислота:
НСООН
 НСОО-
+ Н+
НСОО-
+ Н+
со – исходная концентрация кислоты
a – степень диссоциации
закона
Оствальда 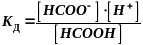
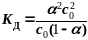
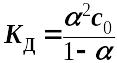
Если
a
< 0,07,
то - упрощенная
формула
- упрощенная
формула
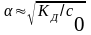 Þ
a
уменьшается с ↑ концентрации
Þ
a
уменьшается с ↑ концентрации
Равновесие диссоциации динамическое Þ его можно сместить в ту или иную сторону (ослабить или усилить диссоциацию)
СН3СООН
 СН3СОО–
+ Н+
СН3СОО–
+ Н+
разбавление: равновесие смещается вправо, т. е. a ↑
введения одноименного иона:
+ СН3СООNH4 ® СН3СОО– + NH4+
↑ С (СН3СОО–) Þ равновесие смещается влево, т. е. a ¯
+ HCl ® Н+ + Сl–
↑ С (Н+) Þ равновесие смещается вправо, т. е. a ↑
