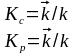- •Лекция 1. Основные понятия и законы Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
- •Лекция 2. Строение атома
- •Ядро электронная оболочка
- •Уравнение де Бройля:
- •Число подуровней Подуровни
- •Лекция 2. Периодическая система элемнтов д.И. Менделеева
- •Валентные свойства атомов
- •Характер изменения свойств атомов и образованных ими простых соединений
- •Лекция 4. Химическая связь
- •3 Связи: σ- и две π – связи, механизм образования - обменный
- •Лекция 5. Метод валентных связей
- •Лекция 6. Взаимодействия между молекулами
- •Силы Ван-дер-Ваальса
- •Индукционная составляющая – электростатическое взаимодействие полярной и неполярной молекул или неполярной молекулы с внешним электростатическим полем.
- •Едисп увеличивается:
- •С увеличением поляризуемости молекул (атомов)
- •С уменьшением расстояния между частицами
- •Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
- •Лекция 8. Энергетика химических процессов
- •С (графит) 5,74 8,54
- •С (графит) 298 – 2300 к
- •Искомая область температур: 982 ÷ 2300 к
- •Лекция 11. Химическое равновесие
- •Лекция 12. Основные понятия химической кинетики
- •Влияние концентрации на скорость реакции
- •Лекция 13. Основы кинетики сложных и гетерогенных реакций
- •Лекция 14. Дисперсные системы и общие понятия о растворах Растворы
- •2. Газообразные: (газовые смеси) Воздух: о2, n2, Ar, н2о (пары)
- •Жидкие растворы
- •Растворы электролитов Растворы неэлектролитов
- •Способы выражения концентрации растворов.
- •Термодинамика процесса растворения
- •Основные стадии процесса растворения:
- •Законы идеальных растворов
- •Осмотическое давление
- •Закон Вант - Гоффа
- •Реальные растворы. Активность.
- •Лекция № 15. Растворы электролитов
- •Ступенчатая диссоциация
- •Расчет рН слабых кислот и оснований
- •Расчет рН сильных кислот и оснований
- •4 Типа солей
- •2) Соли, образованные слабым основанием и сильной кислотой
- •3) Соли, образованные сильным основанием и слабой кислотой
- •4) Соли, образованные слабым основанием и слабой кислотой
- •Гетерогенные равновесия врастворах малорастворимых сильных электролитов
- •Равновесие в растворах комплексных соединений
- •Лекция 17. Окислительно-восстановительные иэлектрохимические процессы
- •Лекция 18. Гальванический элемент
- •Компенсационным методом с помощью переменной внешней эдс
- •Лекция № 20. Электролиз
- •Электроды
- •В случае электролиза раствора Na2so4 (электроды Pt)
- •В случае электролиза раствора NaCl (электроды Pt)
- •Лекция 22. Скорость электрохимической коррозии.
- •Лекция 24. Химическая коррозия металлов
- •Лекция 25. Защита металлов от химической коррозии
- •Лекция 26. Определение возможности коррозии и надежности выбранного метода защиты металла на конкретных примерах
Лекция 13. Основы кинетики сложных и гетерогенных реакций
Гетерогенные реакции идут на поверхности раздела фаз, которая и служит реакционным пространством (поверхностью). Поэтому первой особенностью кинетики этих реакций является влияние площади реакционной поверхности на скорость реакции. С учетом площади поверхности равной S общая скорость гетерогенной реакции первого порядка описывается уравнением:
|
|
|
где с – концентрация реагента (газообразного или жидкого).
Единица измерения скорости гетерогенной реакции в этом случае – мольс1, константы скорости реакции– мс1. Если в реакции непосредственно участвует твердое вещество, то в кинетическое уравнение не входит его концентрация, так как она постоянна.
Например, кинетика гетерогенной реакции
СаО(к) + СО2 = СаСО3(к)
описывается уравнением:
|
Иногда важно знать удельную скорость реакции, отнесенную к единице площади реакционной поверхности, которая для реакции первого порядка описывается уравнением:
|
|
|
Единица измерения удельной скорости реакции мольс1м2.
Скорость гетерогенной химической реакции зависит от скорости подвода реагента и отвода продукта с поверхности раздела фаз (зона химической реакции), что является второй особенностью этих реакций.
С
 корость
обратимых
гетерогенных, как и гомогенных, реакций
зависит от скоростей прямой и обратной
реакций.
корость
обратимых
гетерогенных, как и гомогенных, реакций
зависит от скоростей прямой и обратной
реакций.
Для реакции А + В = Д + К
|
 или kпр
СА С
В = kобр
СD
СK
или kпр
СА С
В = kобр
СD
СK
или СD СK/ СА С В = Kc = kпр/ kобр
Т.е. константа равновесия гетерогенной химической реакции равна отношению констант скоростей прямых и обратных реакций
|
Итак, общая скорость необратимой гетерогенной химической реакции зависит, а удельная скорость реакции не зависит от площади реакционной поверхности. На скорость гетерогенной химической реакции влияют процессы массопереноса. Скорость обратимой реакции определяется разностью скоростей прямой и обратных реакций.
Цепные реакции
Особое место в химической кинетике занимают цепные реакции. Эти реакции имеют ряд особенностей. Скорость их зависит от природы и объема сосуда, от наличия в нем посторонних примесей, для некоторых из них характерен порог давления, ниже которого реакция не идет. При определенных условиях цепная реакция представляет лавинообразный процесс, протекающий чрезвычайно быстро с возможностью взрыва.
Химические превращения с цепным механизмом реакции достаточно распространены в химии газообразных веществ. К цепным реакциям относятся реакции сгорания топлива, окисления молекулярных галогенов кислородом, хлорирования и бромирования, многие процессы полимеризации, крекинг тяжелых нефтепродуктов, процессы получения ядерной энергии и др. Впервые идею о возможности цепного механизма реакций высказал русский ученый Н. А. Шилов в 1905 г. Большой вклад в разработку теории цепных реакций внесли русские ученые и в первую очередь академик Н. Н. Семенов.
Цепными называются химические реакции, в которых появление активной частицы вызывает не одно, а несколько последовательных химических превращений с передачей энергии вновь образующимся частицам. Число химических превращений, вызываемых одной активной частицей – длина цепи
Активными частицами могут быть свободные атомы, ионы, радикалы и возбужденные молекулы. (Свободные радикалы представляют собой частицы, обладающие ненасыщенными валентностями и повышенной реакционной активностью)
Механизм цепных реакций.
1 стадия Цепные реакции начинаются со стадии инициирования или зарождения цепи т.е. образования активных частиц (принято обозначать точкой, поставленной рядом с химическими символами, например Сl·, ОН·, Н·, СН3СО·).
Инициирование происходит в результате воздействия на систему светом, излучением высокой энергии, теплом и т. д.
Потребление энергии на инициирование в цепных реакциях невелико, так как активируются не все молекулы, а только небольшая их доля.
2 стадия - рост (продолжение) цепи. Это процесс интенсивного возрастания скорости за счет химических превращений, вызываемых одной активной частицей. Этот процесс происходит до тех пор, пока существует активная частица.
3 стадия - обрыв цепи. Это процесс, в результате которого активные частицы или исчезают, или дезактивируются. Обрыв цепи может произойти в результате столкновения активной частицы со стенкой сосуда и дезактивации в результате адсорбции на стенке или взаимодействия с другой активной частицей при столкновении.
Вследствие образования активных частиц цепные реакции протекают быстрее реакций, идущих по обычному механизму.
Известны две разновидности цепных реакций: с неразветвленными и с разветвленными цепями.
Первые возникают в том случае, если одна активная частица при своем взаимодействии вызывает образование только одной новой активной частицы.
Разветвленные цепные реакции характеризуются разветвлением цепи, т.е. одна активная частица вызывает образование двух и более активных частиц.
Скорость цепной реакции зависит от:
1. внешних параметров (Р, Т, скорость отвода тепла….)
2. конструкции машины (аппарата, реактора…)
3. присутствия посторонних веществ в зоне реакции
V = Vлимитирующей стадии
В качестве примера рассмотрим реакцию горения водорода в кислороде.
При низкой Т активные частицы не зарождаются (цепная реакция не идет)
Однако при Т близкой к 500 0 С (и невысоких Р) протекает цепная реакция с выделением тепла, заканчивающаяся взрывом (в закрытом сосуде). Взрыв гремучего газа:
-
Н2 + О2 ® 2НО· зарождение цепи
НО· + Н2 ® Н· + Н2О рост цепи
Н· + О2 ® НО· + О· разветвление цепи
О· + Н2 ® Н· + НО· и т.д
Затем возникшие частицы вызывают появление новых; скорость реакции резко возрастает и в конце концов происходит взрыв. Это разветвленная химическая реакция.
По мере изучения цепных реакций выяснилось, что они не представляют собой исключение из правил, а встречаются довольно часто в природе и технике.
В энергетике по цепному механизму идут, например, реакции горения многих газовых смесей в печах, при сварке, резке, пайке металлов, при работе паровых котлов, реакторов, при окислении гидромасел в гидроприводах и т.д. В двигателях внутреннего сгорания цепной характер реакции может вызывать микровзрывы (детонацию), для их предупреждения в топливо вводят антидетонаторы (присадки), на которых происходит обрыв цепей.

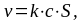
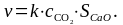
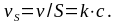
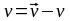 = kпр
СА
С
В –
kобр
СD
СK
= kпр
СА
С
В –
kобр
СD
СK