
- •Лекция 1. Основные понятия и законы Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
- •Лекция 2. Строение атома
- •Ядро электронная оболочка
- •Уравнение де Бройля:
- •Число подуровней Подуровни
- •Лекция 2. Периодическая система элемнтов д.И. Менделеева
- •Валентные свойства атомов
- •Характер изменения свойств атомов и образованных ими простых соединений
- •Лекция 4. Химическая связь
- •3 Связи: σ- и две π – связи, механизм образования - обменный
- •Лекция 5. Метод валентных связей
- •Лекция 6. Взаимодействия между молекулами
- •Силы Ван-дер-Ваальса
- •Индукционная составляющая – электростатическое взаимодействие полярной и неполярной молекул или неполярной молекулы с внешним электростатическим полем.
- •Едисп увеличивается:
- •С увеличением поляризуемости молекул (атомов)
- •С уменьшением расстояния между частицами
- •Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
- •Лекция 8. Энергетика химических процессов
- •С (графит) 5,74 8,54
- •С (графит) 298 – 2300 к
- •Искомая область температур: 982 ÷ 2300 к
- •Лекция 11. Химическое равновесие
- •Лекция 12. Основные понятия химической кинетики
- •Влияние концентрации на скорость реакции
- •Лекция 13. Основы кинетики сложных и гетерогенных реакций
- •Лекция 14. Дисперсные системы и общие понятия о растворах Растворы
- •2. Газообразные: (газовые смеси) Воздух: о2, n2, Ar, н2о (пары)
- •Жидкие растворы
- •Растворы электролитов Растворы неэлектролитов
- •Способы выражения концентрации растворов.
- •Термодинамика процесса растворения
- •Основные стадии процесса растворения:
- •Законы идеальных растворов
- •Осмотическое давление
- •Закон Вант - Гоффа
- •Реальные растворы. Активность.
- •Лекция № 15. Растворы электролитов
- •Ступенчатая диссоциация
- •Расчет рН слабых кислот и оснований
- •Расчет рН сильных кислот и оснований
- •4 Типа солей
- •2) Соли, образованные слабым основанием и сильной кислотой
- •3) Соли, образованные сильным основанием и слабой кислотой
- •4) Соли, образованные слабым основанием и слабой кислотой
- •Гетерогенные равновесия врастворах малорастворимых сильных электролитов
- •Равновесие в растворах комплексных соединений
- •Лекция 17. Окислительно-восстановительные иэлектрохимические процессы
- •Лекция 18. Гальванический элемент
- •Компенсационным методом с помощью переменной внешней эдс
- •Лекция № 20. Электролиз
- •Электроды
- •В случае электролиза раствора Na2so4 (электроды Pt)
- •В случае электролиза раствора NaCl (электроды Pt)
- •Лекция 22. Скорость электрохимической коррозии.
- •Лекция 24. Химическая коррозия металлов
- •Лекция 25. Защита металлов от химической коррозии
- •Лекция 26. Определение возможности коррозии и надежности выбранного метода защиты металла на конкретных примерах
Лекция 12. Основные понятия химической кинетики
Термодинамика
устанавливает принципиальную возможность химического процесса (∆r GТ < 0)
но! не отвечает на вопрос: как быстро идет процесс?
С6Н6(ж) → 6 С(тв) + 3 Н2 (г), ∆r G0298 = - 124,0 кДж
на практике бензол – инертен Þ
кинетические затруднения!
Кинетика изучает механизмы химических процессов, т.е. промежуточные стадии, через которые система переходит из начального в конечное состояние, скорости этих стадий и факторы, влияющие на их скорость.
Скорость реакции (υ) - количество вещества, образующееся в единице реакционного объёма (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции) в единицу времени
Различают:
среднюю и истинную (мгновенную) скорости реакции
υ ср гомогенной реакции в промежуток времени τ1÷ τ2:
 ,
при V=
сonst:
,
при V=
сonst:
 Þ
Þ

[υ] = [моль • л-1• с-1] – всегда положительна величина

Концентрация веществ меняется непрерывно:
исходных – убывает (- ∆c),
продуктов – возрастает (+∆c)
Þ
истинная скорость есть производная функции по τ:
для гомогенной для гетерогенной
реакции

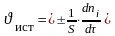
V – объём реакционной зоны;
S – поверхность раздела фаз; t – время;
ni – количество i-го исходного вещества
Для гомогенной реакции:
aA (р) + bB (р) → eE (р ) + fF (р)
в некоторый момент времени:
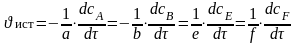
Элементарная реакция (одностадийная):единичный акт образования или разрыва связи, уравнение реакции отражает ее механизм
Сложная реакция (большинство реакций): состоит из нескольких элементарных стадий, уравнение реакции – суммарный результат нескольких элементарных процессов, совокупность элементарных стадий – механизм реакции
Элементарные реакции
В зависимости от числа исходных частиц, различают
1 – мономолекулярные: I2 ® 2I
2 – бимолекулярные: H2 + I2 ® 2HI
3 – тримолекулярные: 2NO + Cl2 ® 2NOCl
Молекулярность бывает: 1, 2, редко 3,
Молекулярность:
число частиц, участвующих в элементарной реакции
имеет физический смысл: М = 1, 2, 3
понятие применимо только к элементарным реакциям
Сложные реакции
протекают по стадиям:
CHCl3 + Cl2 → HCl + CCl4
Cl2 → 2Cl
Cl + CHCl3 → CCl3 + HCl
Cl + CCl3 → CCl4
понятие молекулярности для сложных реакций не имеет смысла
Cкорость реакции, протекающей в газовой фазе или растворе, зависит от:
природы реагирующих веществ,
их концентраций или парциальных давлений
температуры
наличия катализатора
Влияние концентрации на скорость реакции
Химическая реакция протекает при столкновении частиц
Чем ↑ количество частиц в единице V (чем ↑ их концентрация), тем ↑ будет число их соударений.
Вероятность одновременного нахождения частиц в одной точке пространства (Þ их столкновение) пропорциональна произведению концентраций каждой из частиц.
Основной закон (постулат) химической кинетики:
скорость химической реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени
Для элементарной реакции:
aA (р) + bB (р) → продукты
! если в реакции вещество, находящееся в более конденсированном состоянии, в кинетическое уравнение не входит его концентрации, т.к. она постоянна
k – константа скорости реакции:
не зависит от концентрации
зависит от Т, природы реагирующих веществ, катализатора
k
– «удельная скорость»:
если сА
= сВ
= 1моль/л
Þ
 ,
,
а, b – стехиометрические коэффициенты
Для сложной реакции, протекающей в несколько стадий, υ определяется скоростью самой медленной – лимитирующей стадии реакции
aA (р) + bB (р) → продукты

x, y - отличны от стехиометрических коэффициентов
x, y - частные порядки по веществам А и В, определяются экспериментально
n = x + y - общий порядок реакции
В простых (элементарных) реакциях: n = 1, 2, редко 3
В сложных реакциях: n = 0, 1, 2, 3, может быть дробным, (-), (+) – формальная величина, не имеет физического смысла
! n = M – только в элементарных реакциях
Реакции 1-ого порядка
А → продукты CH3OCH3 ® CH4 + H2 + CO
Кинетическое уравнение реакции 1 - порядка:

Разделяем переменные и интегрируем:

- lnc = kIτ + const; при τ→0, с = с0 Þ const = - lnc0
- ln(c/c0) = kIτ Þ
С0 – исходная концентрация
С – концентрация в момент времени t (текущая концентрация)
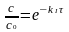
степень превращения вещества! не зависит от c0
[kI ] = [c – 1]
если х – концентрация прореагировавшего вещества Þ
с0 – х = с (текущая) Þ х(τ) = c0( 1 – e –kIτ)
Для оценки степени превращения используют понятие время полупревращения τ1/2 (период полураспада для радиоактивных веществ):
τ, за которое, прореагировала половина исходного количества вещества
 –
не зависит от с0
–
не зависит от с0
Þ при n = 1определяется величиной k1 реакции
Для реакций с n =1 зависимость c f (τ) линейна в координатах lnc – τ (кинетическая кривая реакций 1-го порядка)
lgC

![]()
lgC0
Реакции 2-ого порядка
A + B → продукты 2А ® продукты
Простейший случай: с0A = с0B= с0
В момент времени τ сA = сB = с
2 NO2 → 2 NO + O2

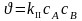

разделяем переменные и интегрируем:

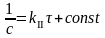 при τ
= 0, С
= С0
Þ
const
= 1/C0
Þ
при τ
= 0, С
= С0
Þ
const
= 1/C0
Þ

 [kII
]
= [л•
моль-1•c
– 1]если
х
– концентрация прореагировавшего
вещества Þ
[kII
]
= [л•
моль-1•c
– 1]если
х
– концентрация прореагировавшего
вещества Þ
 при
n
=2 зависимость
c
f
(τ)
линейна
в координатах
ln(1/c)
- τ
при
n
=2 зависимость
c
f
(τ)
линейна
в координатах
ln(1/c)
- τ
(кинетическая кривая реакций 2-го порядка)
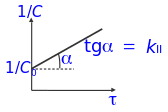
время полупревращения τ1/2 для реакций 2- го порядка

 !
t
½
– обратно пропорционально С0
!
t
½
– обратно пропорционально С0
Реакции 0-го порядка:
А (избыток) → продукты
кинетическое уравнение: υ = -dcA/dτ = k0cA=k0
Стек = С0 – k0t ; t1/2 = С0 /2k0 [ k0] = [ моль×л-1× с-1]
Реакции 3-го порядка:
A + B + D → продукты:
для случая Снач : С0A = С0B = С0D = С0
Стек : СA = СB = СD = С
кинетическое уравнение:
 ;
;
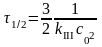 [
kIII]
= [л2×моль-2×с-1]
[
kIII]
= [л2×моль-2×с-1]
υ = -dcA/dτ = k0cA=k0
υ = -dcA/dτ = -dc/dτ = kIIIcAcBcD = kIIIc3
Влияние температуры на скорость рекций
Правило Вант-Гоффа:
при увеличении температуры на 10° скорость реакции возрастает в 2 – 5 раз
эмпирическое, грубое, выполняется в небольшом интервале Т
γ = (2-5) - температурный коэффициент

Резкое ↑ υх. р. при ↑ Т объясняется ↑ числа активных молекул и эффективных соударений ÞДля осуществления химического превращения частицы должны обладать определенным запасом Е (быть активными)
Распределение молекул по Екин при двух температурах
(Максвелла – Больцмана)
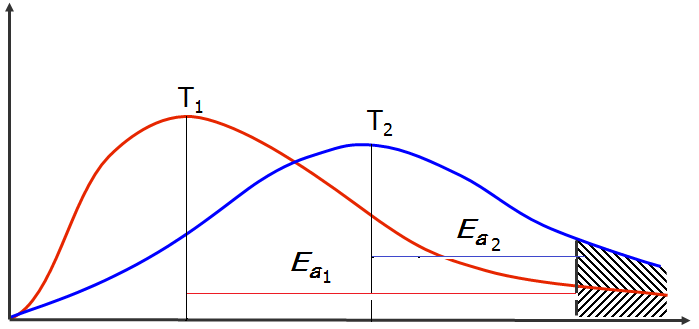
∆N/N
Еср1 Еср2 Е * Екин
∆N/N – доля частиц, имеющих энергию Е
S под кривыми равна общему числу частиц в системе (const)
! частиц, имеющих Еср больше всего (max на кривых)
! В реакцию вступают активные частицы, имеющие
Еа [кЖд/моль] – энергия активации
- минимальная избыточная Е (по сравнению со средней), необходимая для осуществления химического превращения
Е ≥ Е* ; Е*≥ Еср + Еа
Е ≥ Е* ; Е*≥ Еср + Еа
Е
Е ≥ Е* ; Е*≥ Еср + Еа
а зависит от природы реагирующих веществЕа не является f(T) – с ↑ Т ↑ доля активных молекул
Источники активации:
тепловая, электрическая энергия, hv, др. виды излучения
Число
активных частиц:
Nакт
= N
•

УРАВНЕНИЕ АРРЕНИУСА (1889 г.)
k = k0 •
Число активных частиц и Þ υ и k возрастают с ↑Тпо экспоненте
k0 – предэкспоненциальный множитель, (фактор частоты) - показывает долю соударений, приводящих к элементарным химическим превращениям
не зависит от Т
учитывает:
ориентацию частиц во время контакта (стерический фактор)
продолжительность контакта
физический смысл k0: k0 = k , если Еа = 0
Как правило, если Еа:
˃150 кДж/моль - реакции при Ткомн не идут
62 ÷ 150 кДж/моль – имеют измеримые υ, γ = 2÷5
< 62 кДж/моль – идут быстро, ионы в растворе
Еа определяется экспериментально
КАТАЛИЗ
В ходе реакции система проходит переходное состояние – активированного комплекса:старые связи ослабли, новые не сформировались.
Для реакции: АВ + ДС Û АД + ВС

исходные активированный продукты
молекулы комплекс реакции
Еа – энергия необходимая для перехода вещества в состояние активированного комплекса
Энергетическая диаграмма хода реакции с образованием активированного комплекса

↓ Еа можно только используя катализатор: вещество, изменяющее υ, но не испытывающее химических превращений в результате реакции
Катализ:
явление изменения υ реакции за счет введения дополнительных веществ – катализаторов (кt). Различают:
Положительный катализ – процесс, ускоряющий реакцию
Отрицательный катализ – процесс, замедляющий реакцию
кt – ингибиторы (Сl- – ингибитор коррозии)
Автокатализ – kt – один из продуктов реакции
FeO + H2 = Fe + H2O Fe – kt
Гомогенный катализ – kt, все реагенты в одной фазе
H2O2 HI – kt H2O + ½O2
(H+, OH- – самые активные гомогенного kt)
Гетерогенный катализ – реакция на поверхности kt
H2O2 Pt–kt H2O + ½ O2
(Pt - один из самых активных гетерогенного kt )
Особенности kt:
kt – участвует в образовании промежуточных нестойких соединений, а в конце выделяется в химически неизменном виде
небольшие количества kt – резко ускоряют процесс промежуточных стадий (↓Еа ) неkt реакции
kt – не изменяет DrН и DrG: DrG0неkt = DrG0kt
DrG0 = -RTlnKp Þ не влияет на равновесие, только ускоряет его достижение, т.к. в одинаковое число раз изменяет как J прямой р-ции так и Jобр.р-ции
Задача.
В реакции А ® В + С с общим порядком, равным единице, константа скорости k1 = 5×10-5 с-1. Определите концентрацию веществ А и В и скорость реакции через 1 час и через 5 часов, если начальная концентрация А составляла 0,2 моль/л.
Р ешение.
Для реакции 1-го порядка справедливо
уравнение
ешение.
Для реакции 1-го порядка справедливо
уравнение
где с – текущая концентрация вещества в момент времени
τ, с0 – начальная концентрация, k – константа скорости, τ – время.

Ч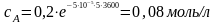 ерез
1 час
ерез
1 час
Через 5 часов
Концентрация вещества В находится по стехиометрическому соотношению веществ А и В. Из уравнения реакции следует, что концентрация вещества В возрастает на ту же величину, на какую убывает концентрация А, т. к. из 1 моль А получается 1 моль В.
Поэтому через 1 час
Ч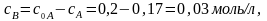
 ерез
5 часов
ерез
5 часов
Рассчитаем скорость реакции по уравнению: υ = k×сА
Ч ерез
1 час
ерез
1 час
Ч ерез
5 часов
ерез
5 часов
