
- •Лекция 1. Основные понятия и законы Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
- •Лекция 2. Строение атома
- •Ядро электронная оболочка
- •Уравнение де Бройля:
- •Число подуровней Подуровни
- •Лекция 2. Периодическая система элемнтов д.И. Менделеева
- •Валентные свойства атомов
- •Характер изменения свойств атомов и образованных ими простых соединений
- •Лекция 4. Химическая связь
- •3 Связи: σ- и две π – связи, механизм образования - обменный
- •Лекция 5. Метод валентных связей
- •Лекция 6. Взаимодействия между молекулами
- •Силы Ван-дер-Ваальса
- •Индукционная составляющая – электростатическое взаимодействие полярной и неполярной молекул или неполярной молекулы с внешним электростатическим полем.
- •Едисп увеличивается:
- •С увеличением поляризуемости молекул (атомов)
- •С уменьшением расстояния между частицами
- •Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
- •Лекция 8. Энергетика химических процессов
- •С (графит) 5,74 8,54
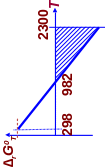
- •С (графит) 298 – 2300 к
- •Искомая область температур: 982 ÷ 2300 к
- •Лекция 11. Химическое равновесие
- •Лекция 12. Основные понятия химической кинетики
- •Влияние концентрации на скорость реакции
- •Лекция 13. Основы кинетики сложных и гетерогенных реакций
- •Лекция 14. Дисперсные системы и общие понятия о растворах Растворы
- •2. Газообразные: (газовые смеси) Воздух: о2, n2, Ar, н2о (пары)
- •Жидкие растворы
- •Растворы электролитов Растворы неэлектролитов
- •Способы выражения концентрации растворов.
- •Термодинамика процесса растворения
- •Основные стадии процесса растворения:
- •Законы идеальных растворов
- •Осмотическое давление
- •Закон Вант - Гоффа
- •Реальные растворы. Активность.
- •Лекция № 15. Растворы электролитов
- •Ступенчатая диссоциация
- •Расчет рН слабых кислот и оснований
- •Расчет рН сильных кислот и оснований
- •4 Типа солей
- •2) Соли, образованные слабым основанием и сильной кислотой
- •3) Соли, образованные сильным основанием и слабой кислотой
- •4) Соли, образованные слабым основанием и слабой кислотой
- •Гетерогенные равновесия врастворах малорастворимых сильных электролитов
- •Равновесие в растворах комплексных соединений
- •Лекция 17. Окислительно-восстановительные иэлектрохимические процессы
- •Лекция 18. Гальванический элемент
- •Компенсационным методом с помощью переменной внешней эдс
- •Лекция № 20. Электролиз
- •Электроды
- •В случае электролиза раствора Na2so4 (электроды Pt)
- •В случае электролиза раствора NaCl (электроды Pt)
- •Лекция 22. Скорость электрохимической коррозии.
- •Лекция 24. Химическая коррозия металлов
- •Лекция 25. Защита металлов от химической коррозии
- •Лекция 26. Определение возможности коррозии и надежности выбранного метода защиты металла на конкретных примерах
С (графит) 298 – 2300 к
СО2 (г) 298 – 2500 К
СО (г) 298 – 2500 К Þ
Искомая область температур: 982 ÷ 2300 к
Лекция 11. Химическое равновесие
Состояние системы, при котором энтальпийный и энтропийный факторы уравновешиваются Þ ∆r GТ = 0
∆r GТ = ∆r HТ - T∆r SТ = 0 ∆r HТ = T∆r SТ
Þ возможности самопроизвольного протекания прямой и обратной реакции равновероятны Þ парциальные давления и концентрации всех компонентов реакции постоянны во времени и во всех точках системы - равновесные давления и концентрации.
При равновесии химической реакции:
aA(г) + bB(г)+ dD(к) eE(г) + fF(г)
Δr
GТ
=
∆r
G0Т
+ RTln
 = 0 Þ
= 0 Þ
! под знаком логарифма относительные равновесныедавления
∆ r
G0Т
= -– RTln
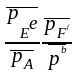
Если реакция aA (р) + bB (р)+ dD (к ) eE (р ) + fF (р) протекает в идеальном растворе:
∆r
G0Т
= – RTln
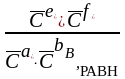
Математическое выражение закона действующих масс (ЗДМ) для равновесного состояния:
Кс =
Кр
=

Кс и Кр - константы равновесия
∆r G0Т = - RTlnКр для реакций в газовых системах (1)
∆r G0Т = - RTlnКс - для реакций в конденсированных системах (1′)
Кр и Кс
определяются природой веществ
зависят от Т
не зависят от:
парциальных давлений
концентраций компонентов
общего давления в системе
Кр и Кс - характеризуют выход продуктов реакции
Из уравнений (1), (1′) следует:
Δr G0Т < 0,
если lnКравн ˃ 0, т.е. Кравн ˃ 1 Þ равновесие смещено вправо
(в равновесной смеси больше продуктов)
Δr G0Т ˃ 0,
если lnКравн < 0, т.е. Кравн < 1 Þ равновесие смещено влево
(в равновесной смеси больше исходных веществ)
Соотношение Кр и Кс для газофазной реакции
Парциальные давления газов характеризуют их содержание в реакционной смеси и м. б. заменены на концентрации.
Для реакции:
aA(г) + bB(г)+ dD(к) eE(г) + fF(г)
Кр
=
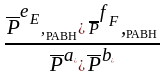 =
=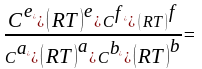
=

Кр = Кс(RT)∆ν
∆ν = (e + f) – (a + b) – изменение числа молей газов в результате реакции
! R = 0,082 атм.л.моль-1.К-1
Выражение Кр - через равновесные количества молей газообразных компонентов ni (равн) и общее давление P0:
pi
=
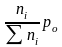 - парциальное
давление компонентов
- парциальное
давление компонентов
Σni = nE равн + nF равн + nA равн + nB равн
Кр
=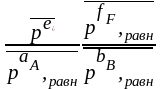 =
=
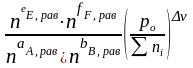
Зависимость константы равновесия от температуры
∆r G0Т = - RTlnКр = ∆r H0 - T∆r S0
lnKp
= - =
=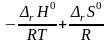 ,
с учетом ∆rH0
и ∆rS0
¹
f(T)
,
с учетом ∆rH0
и ∆rS0
¹
f(T)
уравнение изобары Вант-Гоффа
если ∆r H0 < 0 Þ d lnKp/dT < 0 Þ Кр уменьшается с ↑ Т равновесие смещается влево, в сторону исходных веществ
если ∆r H0 > 0 Þ d lnKp/dT > 0 Þ Кр увеличивается с ↑ Травновесие смещается вправо, в сторону продуктов реакции
После интегрирования изобары с учетом ∆r H0 ¹ f(T) при Т2 > Т1 :

Принцип Ле Шателье
если на систему, находящуюся в истинном равновесии, воздействовать извне, то равновесие смещается в сторону уменьшения эффекта внешнего воздействия
Равновесие смещается:
при ↑ Т Þ в сторону эндотермической реакции
при ↑ Робщего Þ в сторону образования меньшего числа моль газообразных реагентов
при ↑ Рисходных веществ Þ в сторону продуктов реакции
при ↑ Сисходных веществ или при ↓ Спродуктов реакции Þ в сторону продуктов
ЗАДАЧА
Рассчитайте Кр и Кс реакции
С(к)
+ СО2(г)
![]() 2СО(г)
2СО(г)
при 298 К и 1000 К. Сделайте вывод о выходе продукта реакции и определите знак энтальпии реакции.
Решение:
Кр
=
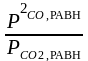 ;
Кс
=
;
Кс
=
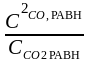
∆r G0Т = –RT lnКр Þ Kp = exp(–∆G0Т /RT)
∆r G0298 = 120,15 кДж; ∆r G01000 = –3,16 кДж
Кр298 = exp(–120 · 103 / 8,31· 298) = ехр( –48,5) = 8 × 10–22
Kp1000 = exp(+3160 / 8,31 · 1000) = ехр(0,38) = 1,46
(обратите внимание на размерность!)
Кс
=
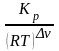 =
=
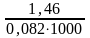 = 0,018
= 0,018
∆ν = 2-1=1 - изменение числа молей газообразных веществ!
При 298 К: Кр ® 0 Þ в равновесной смеси практически отсутствуют продукты Þ смещение равновесия в сторону исходных веществ.
При 1000 К: Кр > 1 Þ в равновесной смеси начинают преобладать продукты, их выход растет с ↑ Т,с ↑ Т значение Кр увеличивается Þ ∆r H0 > 0.
ЗАДАЧА
Определить равновесный состав системы
С(к) + СО2(г) 2СО(г)
Т= 1000 К Робщ = 2атм nисх, CO2 = 5 моль
Решение:
Реакция идет при P = const!
Kp =exp(- ∆G0Т /RT)
Kp1000 = exp(+3160/8,31.1000)= ехр(0,38) = 1, 46
Компонент |
С |
СО2 |
2СО |
Начальный состав, моль |
- |
5 |
0 |
Изменение состава, моль |
- |
х |
2 x |
Равновесный состав, моль |
- |
5 – x |
2 x |
Кр
=
=
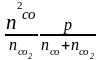 =
=
=
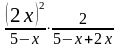 = 1,46 Þ
х
= 1,7 моль.
= 1,46 Þ
х
= 1,7 моль.
Равновесный: n(СО2) = 5 - 1,7 = 3,3
состав: n(СО) = 2×1,7 = 3,4.
ЗАДАЧА
Определите сравн СО2 и СО для реакции
С(к) + СО2(г) 2СО(г)
Т = 1000 К , Vсосудa = 2 л, mисх (СО2) = 44 г,
Рассчитайте, на сколько изменится давление в системе при равновесии по сравнению с исходным
Решение:
Реакция идет при V = const!
сСО2
=
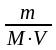 =
=
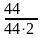 = 0,5 моль/л; Кс,
1000
= 0,018
= 0,5 моль/л; Кс,
1000
= 0,018
Таблица материального баланса:
Компонент |
С |
СО2 |
2СО |
сисх, моль/л |
- |
0,5 |
0 |
Δс, моль/л |
- |
х |
2 x |
сравн, моль/л |
- |
0,5 – x |
2 x |
Кс
=
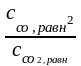 =
=
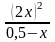 = 0,018 Þ
х =
0,0387 моль/л
= 0,018 Þ
х =
0,0387 моль/л
сСО, равн = 2. 0,0387 = 0,0774 моль/л
сСО2, равн = 0,5 - 0,0387 = 0,4613 моль/л
Р0 = сRT = 0,5.0,082•1000 = 41атм
Рравн = (0,5 – х + 2х)RT = 44,173 атм Þ DР = 3,173атм
Адсорбция - поглощение одного вещества поверхностью другого вещества
Адсорбция – разновидность сорбции- поглощения одного вещества другим.
Если вещество поглощает всем объемом, то происходит
абсорбция
Адсорбция осуществляется вследствие наличия у поверхностных частиц избыточной поверхностной свободной энергии. Наличие неуравновешенной энергии у поверхностной частицы по сравнению с частицей в объеме приводит к накоплению тех или иных веществ на границе раздела фаз ( тв-г, тв-ж, ж-г) т.е. происходит повышение концентрации вещества на границе раздела фаз - адсорбция
Адсорбент - вещество, которое поглощает, адсорбирует
Адсорбат – адсорбированное вещество, которое поглощается.
Десорбция - процесс, обратный адсорбции.
Количественной характеристикой адсорбента является его удельная площадь поверхности S0
S0 = S/ V, м2см-3
S0= S/ m, м2г-1
Чем больше S0, тем лучше адсорбционная способность адсорбента. Большой S0 обладают активированные угли, цеолиты, алюмосиликаты, силикагель (аморфный кремнезем) – вещества с развитой поверхностью.
S0 активированного угля достигает величины, равной 400 – 900 м2 г-1
Количественная мера адсорбции адсорбата является величина адсорбции Г - избыток адсорбированного вещества в поверхностном слое и в объеме.
[Г]=[моль/м2]; [моль/см2адсорбента]; [моль/г адсорбента]
Физическая адсорбция
- при взаимодействии адсорбата и адсорбента возникают вандерваальсовы взаимодействия (физическая природа сил); невысокий тепловой эффект (DН298 = –(8 – 20)кДж/моль); обратимый процесс - десорбция↑ с ростом Т.
Химическая адсорбция (хемосорбция)
- при взаимодействии адсорбата и адсорбента возникают химические связи (химическая природа сил); тепловой эффект = DН химических реакций;
необратимый процесс.
Термодинамика адсорбции
Адсорбция протекает самопроизвольно ÞDGадс < 0.При взаимодействии адсорбата с адсорбентом теплота выделяется Þ DНадс < 0.В процессе адсорбции происходит упорядочение адсорбированных частиц Þ DSадс < 0.
При некоторой температуре Тр наступает равновесие, когда скорость адсорбции равна скорости десорбции υад = υдес
D Gадс
= 0 и Тр
= DНадс/DSадс.
Gадс
= 0 и Тр
= DНадс/DSадс.
С увеличением Т адсорбция ↓, десорбция ↑.
Изотерма адсорбции - зависимость адсорбции Г от равновесной концентрации с или равновесного парциального давления р адсорбата при постоянной температуре Г = f (c), Г = f (p)
Наиболее часто используются уравнения Лэнгмюра и Фрейндлиха.
Уравнение Лэнгмюра (предполагает, что поверхность адсорбента однородна и при максимальном заполнении образуется мономолекулярный слой).
Q = Г/Г¥(*) - степень заполнения поверхности адсорбатом.
1- Q - свободная поверхность
Г¥ – максимальная адсорбция (при образовании монослоя);
υад = kад(1- Q)рА – для адсорбции газа на свободной поверхности
υад = kад(1- Q)сА – для адсорбции адсорбата А из раствора
υдес = kдесQ - пропорционально занятой поверхности
При равновесии υад = υдес Þ kад(1- Q) рА = kдесQ
Ка = kад/ kдес =Q/(1- Q) рА Þ (*)
или Ка = kад/ kдес =Q/(1- Q) сА Þ (*)
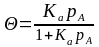 или
или
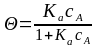 (**)
(**)
Уравнение адсорбции Лэнгмюра имеет вид:
или
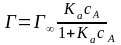

сА – равновесная концентрация адсорбата;
рА – равновесное давление адсорбата;
Ка – константа адсорбционного равновесия.
При малых концентрациях и парциальных давлениях адсорбция пропорциональна концентрации или парциальному давлению.
При высоких концентрациях, когда Кас >> 1, достигается максимальное заполнение Г = Г¥.
Характеристики адсорбента Г¥ и Ка находят графически по экспериментальным данным.
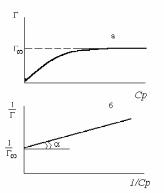
Уравнение Лэнгмюра (***) в координатах обратной адсорбции 1/Г и обратной концентрации 1/с
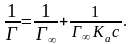
На оси ординат отсекается отрезок, равный 1/Г¥, а tga = 1/(КаГ¥).
Графическое изображение изотермы адсорбции Лэнгмюра.
(Изотерма Лэнгмюра в двух формах)
Общие закономерности адсорбции на поверхности твердых тел:
- адсорбция из растворов идет медленнее адсорбции газов,
- адсорбция зависит от природы адсорбента и адсорбата (так, актив. Уголь хорошо адсорбирует газы Cl2, SO2 и не адсорбирует H2O, O2, N2, H2, CO)
- сильнее из растворов адсорбируются вещества с меньшей растворимостью;
- адсорбенты, плохо смачиваемые водой (уголь, тальк)
адсорбируют органические вещества из водных растворов;
- из раствора электролита адсорбируются ионы одного вида.
Применение адсорбции
На этом явлении основаны:
- способы очистки газов и жидкостей от примесей;
- способы разделения смесей газов и жидкостей и анализ компонентов методами хроматографии;
- использование ПАВ (поверхностно активных веществ) в быту и производствах.
