
- •Лекция 1. Основные понятия и законы Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
- •Лекция 2. Строение атома
- •Ядро электронная оболочка
- •Уравнение де Бройля:
- •Число подуровней Подуровни
- •Лекция 2. Периодическая система элемнтов д.И. Менделеева
- •Валентные свойства атомов
- •Характер изменения свойств атомов и образованных ими простых соединений
- •Лекция 4. Химическая связь
- •3 Связи: σ- и две π – связи, механизм образования - обменный
- •Лекция 5. Метод валентных связей
- •Лекция 6. Взаимодействия между молекулами
- •Силы Ван-дер-Ваальса
- •Индукционная составляющая – электростатическое взаимодействие полярной и неполярной молекул или неполярной молекулы с внешним электростатическим полем.
- •Едисп увеличивается:
- •С увеличением поляризуемости молекул (атомов)
- •С уменьшением расстояния между частицами
- •Лекция 7. Зависимость свойств веществ от типов взаимодествии между частицами
- •Лекция 8. Энергетика химических процессов
- •С (графит) 5,74 8,54
- •С (графит) 298 – 2300 к
- •Искомая область температур: 982 ÷ 2300 к
- •Лекция 11. Химическое равновесие
- •Лекция 12. Основные понятия химической кинетики
- •Влияние концентрации на скорость реакции
- •Лекция 13. Основы кинетики сложных и гетерогенных реакций
- •Лекция 14. Дисперсные системы и общие понятия о растворах Растворы
- •2. Газообразные: (газовые смеси) Воздух: о2, n2, Ar, н2о (пары)
- •Жидкие растворы
- •Растворы электролитов Растворы неэлектролитов
- •Способы выражения концентрации растворов.
- •Термодинамика процесса растворения
- •Основные стадии процесса растворения:
- •Законы идеальных растворов
- •Осмотическое давление
- •Закон Вант - Гоффа
- •Реальные растворы. Активность.
- •Лекция № 15. Растворы электролитов
- •Ступенчатая диссоциация
- •Расчет рН слабых кислот и оснований
- •Расчет рН сильных кислот и оснований
- •4 Типа солей
- •2) Соли, образованные слабым основанием и сильной кислотой
- •3) Соли, образованные сильным основанием и слабой кислотой
- •4) Соли, образованные слабым основанием и слабой кислотой
- •Гетерогенные равновесия врастворах малорастворимых сильных электролитов
- •Равновесие в растворах комплексных соединений
- •Лекция 17. Окислительно-восстановительные иэлектрохимические процессы
- •Лекция 18. Гальванический элемент
- •Компенсационным методом с помощью переменной внешней эдс
- •Лекция № 20. Электролиз
- •Электроды
- •В случае электролиза раствора Na2so4 (электроды Pt)
- •В случае электролиза раствора NaCl (электроды Pt)
- •Лекция 22. Скорость электрохимической коррозии.
- •Лекция 24. Химическая коррозия металлов
- •Лекция 25. Защита металлов от химической коррозии
- •Лекция 26. Определение возможности коррозии и надежности выбранного метода защиты металла на конкретных примерах
Лекция 1. Основные понятия и законы Химия – естественная наука, изучающая состав, строение, свойства и превращения веществ, а также явления, сопровождающие эти превращения.
Закон сохранения массы (Ломоносов, Лавуазье, к. XVIII в.): масса веществ, вступающих в реакцию, равна массе веществ, получающихся в результате реакции.
Закон эквивалентов (Рихтер и др., н. XIX в.): разные вещества, обладающие разной массой могут быть равносильны (т.е. эквивалентны) по химическому действию
56 г KOH
36 г HCl <
40 г NaOH
Все вещества реагируют в эквивалентных отношениях.
Закон постоянства состава (Пруст, н. XIX в.): чистое вещество имеет всегда один и тот же количественный состав независимо от способа его получения
H2O
2 : 16
1 г + 8 г → 9 г H2O
Закон кратных отношений (Дальтон, н. XIX в.): если два простых вещества, соединяясь, образуют несколько соединений, то массы одного из них, отнесенные к одной и той же массе другого, относятся между собой как небольшие целые числа
H2O H2O2
2 : 16 2 : 32
1 : 8 1 : 16 O : O = 1 : 2
Атомистическая теория (Ломоносов, Дальтон, н. XIX в.): все вещества состоят из атомов.
принята в 1860 г. – Международный съезд химиков.
С 1897 г. – открытие физиками:
электрона (Томсон)
ядра атома (Резерфорд)
нейтрона (Чедвик)
теории строения атома водорода (Нильс Бор) и др.
волнового характера электрона (Луи де Бройль)
заряда ядер (Мозли)
Лекция 2. Строение атома
Атом - сложная электромагнитная микросистема, являющаяся носителем свойств химического элемента
АТОМ
Ядро электронная оболочка
электроны (е-)
протоны (р, р+) - е- - элементарная отрицательная частица,
нейтроны (n, no) носитель наименьшей массы и
другие микрочастицы (> 34) наименьшего электрического заряда
- в ядре сосредоточен весь + заряд и 99,98 % массы атома
- заряд ядра равен числу протонов в нем
Частица |
Кто и когда открыл |
Система СИ Заряд, Кл |
Атомные ед. заряда |
Система СИ масса, кг |
Атомные ед. массы |
е- |
Дж. Томсон, 1897 |
1,6.10 -19 |
- 1 |
9,11.10-31 |
0,000548 |
р+ |
Э. Резерфорд 1911-1919 |
1,6.10 -19 |
+ 1 |
1,6.10-27 |
1,007 |
n0 |
Дж. Чедвик, 1932 |
0 |
0 |
1,6.10-27 |
1,008 |
Число р в ядре = числу е- в электронной оболочке атома Þ Атом в целом нейтрален, не имеет заряда.
Совокупность атомов с одинаковым зарядом ядра называется химическим элементом.
Сумма числа протонов (Z) и нейтронов (N) называется массовым (нуклонным) числом (А),
Z + N = A
Разновидности атомов одного химического элемента, имеющие одинаковый заряд ядра, но разные массовые числа называют изотопами. Относительные атомные массы элементов не являются целыми числами, т.к. элементы представляют собой смеси изотопов.
Пример:
массовое
число
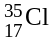 (хлор-35, (17 p+,
18 n,
17e-))
(хлор-35, (17 p+,
18 n,
17e-))
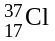 (хлор-37, (17
p+,
20 n,
17e-))
(хлор-37, (17
p+,
20 n,
17e-))
Аr(Cl) = 35 · 0,7543 + 37 · 0,2457 = 35,491 а.е.м.
В результате химических реакций ядро атома не претерпевает изменений, изменяются лишь е- - оболочки атомов.
Состояние е- в атоме описывается законами
квантовой механики.
! Квантование энергии (Е): Макс Планк (1900 г., Германия) –
Е распространяется и передается, испускается и поглощается не непрерывно, а дискретно, отдельными порциями - квантами.
Е кванта ~ частоте излучения ν:
E = h·ν,
h – постоянная Планка (6, 626 · 10 –34 Дж · с)
ν = с/λ, с – скорость света (3 · 108 м/с), λ – длина волны.
Þ
Чем ↓ длина волны (чем ↑ частота излучения), тем ↑Е кванта
! Дуализм электрона: (Луи де Бройль, 1924 г., Франция) -
е- характеризуется двойственной (корпускулярно-волновой) природой, т.е. обладает свойствами и частицы и волны.
е- - частица: m, mv е- -волна: λ, ν
