
- •1. Технологія горілок
- •1.1. Вимоги до води
- •Класифікація води , яку використовують для приготування горілки.
- •1.2. Властивості водноспиртових розчинів Вимоги до води що застосовується у лікеро-горілчаному виробництві
- •Залежність розчинності гідрокарбонату кальцію у водно-спиртових сумішах від їх складу і температури (за я.В.Зельцером)
- •Залежність розчинності (в перерахунку на ) від вмісту спирту у горілці та температури
- •1.3. Підготування води
- •1.3.1. Коагуляція колоїдних домішок Освітлення
- •Дози коагулянту (у мг/л) для обробки води*.
- •1.3.2. Знебарвлення і дезодорування води
- •Ефективність очищення води коагуляцією і обробкою аніонітом іа-1р
- •1.3.3. Іонообмінне пом’якшення води
- •1.3.4. Катіонітовий фільтр та його підготовка до роботи.
- •1.3.5. Вапняно-содове пом’якшення води.
- •1.3.6. Демінералізація води.
- •1.3.7. Зворотноосмотичний спосіб водоочищення.
- •1.3.8. Зниження лужності технологічної води.
- •1.3.9. Виведення органічних речовин з води, що йде на виготовлення горілки.
- •Обробка активованого вугілля.
- •1.3.10. Видалення заліза із води.
- •1.3.11. Видалення заліза фільтрацією через зернистий шар піску.
- •1.3.12. Видалення заліза реагентним способом.
- •1.4. Етиловий спирт, його приймання та зберігання.
- •1.4.1. Властивості етилового спирту
- •1.4.2. Властивості харчового етилового спирту
- •1.4.3. Вплив домішок на органолептичні показники спирту.
- •1.4.4. Приймання спирту.
- •1.4.5. Зберігання спирту
Залежність розчинності гідрокарбонату кальцію у водно-спиртових сумішах від їх складу і температури (за я.В.Зельцером)
-
Вміст спирту, % мас.
Розчинність (в мг-екв/л) при температурі,
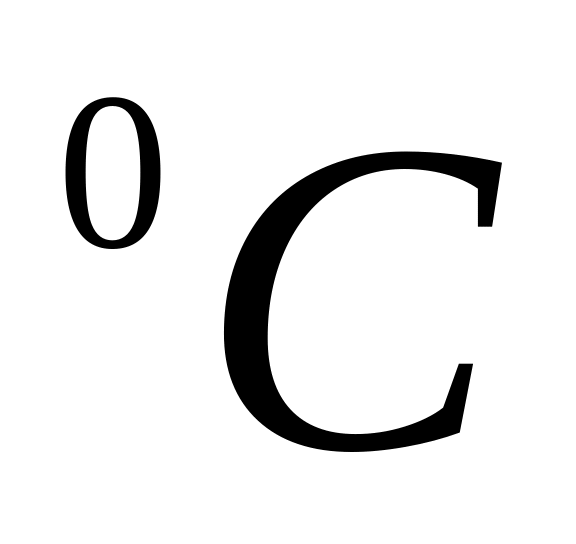
10
20
30
25,0
1,674
1,483
1,325
35,0
1,224
1,085
0,969
40,0
1,047
0,927
0,825
45,0
0,894
0,793
0,709
Катіони магнію та інших металів не мають істотного впливу на розчинність гідрокарбонату.
![]() [1]
[1]
де
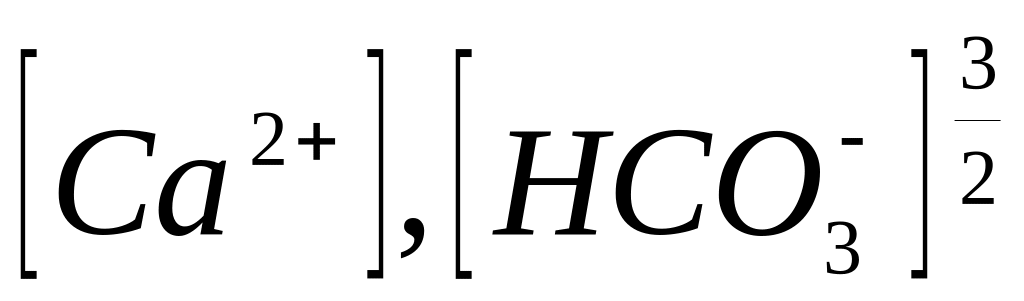 - концентрації відповідних іонів
- концентрації відповідних іонів
q – вміст спирту у водно-спиртовій суміші, % мас.
Вуглекислий
магній
у 40%-ій горілці може випадати в осад при
вмісті його більшому ніж 125 мг (у
перерахунку на
![]() )в
1л.
)в
1л.
Розчинність
![]() та
та
![]() (в
мг/л) залежить від міцності горілки і
температури (табл.3,4).
(в
мг/л) залежить від міцності горілки і
температури (табл.3,4).
Таблиця 4.
Залежність розчинності (в перерахунку на ) від вмісту спирту у горілці та температури
-
Вміст спирту, % об.
Розчинність (в мг/л) при температурі,0С
20
5
-10
-25
40,0
18,5
17,8
16,6
14,8
50,0
16,5
16,0
14,6
13,6
56,0
14,4
14,0
12,5
10,8
Таблиця 5.
Залежність розчинності (в перерахунку на ) від вмісту спирту у горілці та температури
-
Вміст спирту, % об.
Розчинність (в мг/л) при температурі,0С
20
5
-10
-25
40,0
20,0
19,0
18,3
17,5
50,0
18,2
17,5
16,8
15,6
56,0
16,6
15,5
13,3
11,8
Розчинність, вказана в таблицях 4, 5, справедлива тільки при відсутності інших солей твердості. Повне врахування всіх чинників, що мають вплив на утворення осаду в горілках, є досить складним, тому на практиці користуються встановленим А.Н.Граціановим співвідношенням некарбонатної і загальної твердості 13.
За даними С.А.Прусової, у водно-спиртових сумішах міцністю 40% повинно міститися не більше ніж 11,46 мг/л.
Встановлено, що зі збільшенням лужності вміст солей кальцію у водно-спиртових сумішах повинен спадати.
Смак води залежить від розчинених у ній газів і солей. Встановлено, що він покращується зі зростанням вмісту кисню (залежить від температури води). При парціальному тиску кисню в атмосферному повітрі 0,021 МПа і температурі 20 0С в 1л води розчиняється 9,09мг кисню. Зі зменшенням температури розчинність кисню зростає, наприклад, при 15 0С вона рівна 10,06 мг/л.
Вуглекислий
газ,
залежно від pH
води, може знаходитися у вільному стані
(при pH<4,5),
напівзвязаному
– у вигляді гідрокарбонатних іонів
![]() (при
ph 8,4) і звязаному
(при ph>10,5).
(при
ph 8,4) і звязаному
(при ph>10,5).
![]() , що знаходиться у так званій вуглекислотній
рівновазі з іонами
і
, що знаходиться у так званій вуглекислотній
рівновазі з іонами
і
![]() , хімічно неактивний. Внаслідок низького
вмісту
в атмосферному повітрі у водах відкритих
водоймищ його майже немає. У воді
підземних джерел вміст
може складати декілька десятків мг на
1л. Вільний вуглекислий газ позитивно
впливає на органолептичні властивості
деяких спиртованих напоїв.
, хімічно неактивний. Внаслідок низького
вмісту
в атмосферному повітрі у водах відкритих
водоймищ його майже немає. У воді
підземних джерел вміст
може складати декілька десятків мг на
1л. Вільний вуглекислий газ позитивно
впливає на органолептичні властивості
деяких спиртованих напоїв.
Азот (як інертний газ) на смак води не впливає.
NH3 та H2S мають неприємні смак та запах. У водах поверхневих джерел сірководень, зазвичай, не міститься, так як легко окислюється. Присутність його у підземних водах пояснюється відновленням і розкладом гіпсу, сірчистого колчедану та ін.
У воді містяться також органічні речовини (амінокислоти, аміни, білки, редукуючі цукри, полісахариди, карбонові кислоти, ефіри, фульвенові кислоти). Звичайно, органічні сполуки надають воді солодкуватий присмак. Присутні також гумі-речовини, що забарвлюють воду у жовтий колір.
Особливо
значний вплив на смак води мають
мінеральні речовини. Присутність у
значних кількостях хлористого натрію
надає їй солонуватого присмаку, сульфатів
натрію та магнію – гіркуватий, сульфату
![]() та солей цинку – в’яжучий, квасців –
кислуватий солей двовалентного заліза
→ металічний ← солей міді кристалічний.
та солей цинку – в’яжучий, квасців –
кислуватий солей двовалентного заліза
→ металічний ← солей міді кристалічний.
За дослідженнями Я.В.Зельцера, найкращий смак мають горілки, що містять наступні солі (у мг-екв/л):
![]() ;
;
![]() ;
;
![]() ;
;![]() ;
;
![]() ;
;
![]() ;
;
![]() .
.
За даними
А.С.Єгорова, П.Н.Лавришевої, Г.С.Томашевич,
високі органовмісткі показники має
горілка, що містить в 1 дал 136мг
![]() ,
564мг
,
564мг
![]() і 50мг
і 50мг![]() .
.
Г.І.Фертман встановив позитивний вплив калієвих солей: хлориду (4 мг-екв/л) і гідрокарбонату (6 мг-екв/л).
Відповідно,
єдиної думки про оптимальний сольовий
склад води властиво немає, проте
безперечно, що гідрокарбонати
![]() і
і
![]() ,
у невеликій кількості гідрокарбонати
,
хлориди
,
відіграють позитивну роль.
,
у невеликій кількості гідрокарбонати
,
хлориди
,
відіграють позитивну роль.
