
- •Глава 1. Структурно-функциональная
- •Глава 2. Разнообразие и функционирование биосистем
- •Глава 3. Разнообразие и
- •Глава 4. Разнообразие и эволюция
- •Глава 1. Структурно-функциональная
- •Глава 2. Разнообразие и функционирование
- •Глава 3. Разнообразие и функциональная
- •Глава 4. Разнообразие и эволюция............................87
Глава 3. Разнообразие и
ФУНКЦИОНАЛЬНАЯ УСТОЙЧИВОСТЬ
ЭКОСИСТЕМ
Структурно-функциональная организация экосистем
Мы уже отмечали, что структурно-функциональная организация является важнейшим свойством живых систем, а ее изучение стало возможным не только вследствие применения эколого-эволюционного (содержательного) и системно-структурного (формального) подходов при анализе биологических систем (Маркович, Депенчук, 1970; Риклефс, 1979; Шеляг-Сосонко, Дидух, 1979; Уиттекер, 1980), но также и в результате последующей интеграции этих подходов при изучении структуры сообществ, ее изменений в пространстве и во времени (Мазинг, 1973; Одум, 1975,1986а; Численко, 1981; Ахлибинский, 1986; O'Neill et al., 1986; Шеляг-Сосонко и др., 1991).
В связи с тем, что структурно-функциональная организация является основополагающей характеристикой биосистем организменного и надор-ганизменных уровней интеграции (Корнакер, 1970; Коган, 1977а; Энгель-гард, 1984; Алеев, 1986; Емельянов и др., 1986; Песков, Емельянов, 1987, 1988; Плотников, 1989; Межжерин и др., 1991), то, как уже обсуждалось, правомочно при анализе этой важнейшей характеристики использовать функцию энтропии для оценки количества информации (разнообразия), содержащейся в структуре биосистем надорганизменных уровней (Кам-шилов, 1966; Виленкин, 1967; Kohn, 1967; Шмальгаузен, 1960а, 1968; Margalef, 1969; Корнакер, 1970; Уоддингтон, 1970; Одум, 1975,1986а; Гиля-ров, Маркина, 1976; Наумов, 1977; Николис, Пригожий, 1979; Алимов, 1980; Песенко, 1982; Zaret, 1982; Второе, Второва, 1983; Черных, 1986; Айламазян, Стась, 1989). При этом, очевидно, нужно учитывать, что предложенный показатель (индекс Шеннона) отражает степень функционального единства компонентов биосистем, обеспечивающего их нормальное существование в конкретных условиях среды. Здесь следует отметить, что разнообразие повышается по мере увеличения числа элементов и их выровненности и наоборот — снижается при сокращении числа элементов и возрастании их невыровненности, причем увеличение разнообразия приводит к повышению сложности системы и ее организованности
61
РАЗНООБРАЗИЕ И ФУНКЦИОНАЛЬНАЯ УСТОЙЧИВОСТЬ ЭКОСИСТЕМ
(Тюхтин, 1980).
Сегодня общее признание получило положение, что биосистемы разной степени интеграции от организма до биосферы включительно представляют собой диссипативные структуры (открытые, саморегулируемые и самовоспроизводящиеся системы, поддерживающие себя в состоянии, далеком от термодинамического равновесия). В этом плане "одной из главных задач современной теоретической биологии является приложение теории дисснпативных структур к анализу динамики биосистем, будь то процессы исторического (филогенез) или индивидуального (онтогенез) развития организмов" (Родин, 1991; с. 17).
Ранее уже указывалось, что оценка информационно-энергетического состояния организмов (как целостных систем) обусловливает необходимость учета их структурно-функциональной организации и может проводиться по характеру скоррелированности многочисленных структур (отдельных компонентов) — органов и систем органов. Что же касается биосистем надорганизменных уровней интеграции (популяций, биотических сообществ (биоценозов) и т.п.), то поддержание их энергетического баланса обеспечивается либо путем дифференцированного использования поступающей энергии (в виде ресурсов экосистемы) различными внут-рипопуляционными группировками, либо энергетической дифференциацией видовых популяций, определяющей их роль в той или иной экосистеме (доминанты, субдоминанты и сателлиты). Последнее, как уже отмечалось, позволяет производить оценку информационно-энергетических состояний надорганизменных систем по изменению их структурных характеристик: для популяций — внутрипопуляционной структуры, для биотических сообществ (биоценозов) — структуры функциональных группировок, видового разнообразия, сложности сообществ.
Особую актуальность в настоящее время приобретает исследование динамики биосистем (характера их изменений во времени) в современных условиях, когда практически все экосистемы испытывают в большей или меньшей степени дополнительную нагрузку, связанную с глобальным антропогенным воздействием на биосферу.
Каким же образом происходит воздействие человека на экосистемы и что можно ожидать в результате такого воздействия? Ответ на этот вопрос крайне важен, так как только при выяснении тенденции изменений в структуре экосистем можно выйти на уровень построения прогностических моделей их функционирования и сохранения устойчивости. Однако, по-видимому, выявление только одних тенденций изменений в структурно-функциональной организации экосистем будет явно недостаточным
62
СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ ЭКОСИС
для последующего моделирования возможных процессов в них. Поэтому необходима разработка теоретических основ функционирования экосистем, так как "глобальный характер современных экологических трудностей требует некоего глобального системного подхода к их преодолению, когда комплекс частных решений основьгеается на едином принципе. Последний должен быть всеобщим философским принципом, а не частным положением, претендующим на глобальный статус" (Горелов, 1985; с. 39).
Экосистемная теория основьгеается на том, что имеются некие "эмер-джвнтные" признаки, присущие сообществу как целому и не свойственные отдельным видовым популяциям организмов. К таким признакам обычно относят показатели потока энергии через сообщества, их структуру, видовое разнообразие и др. При этом для них характерна некоторая инвариантность, диктуемая термодинамическими принципами, т.е. взаимодействие видовых популяций в сообществах обусловлено специфическими ограничениями, накладываемыми на поведение каждой из взаимо-действущих популяций (Лекявичюс, 1986).
Если подойти к рассмотрению структурной организации экосистем с позиций системного анализа, то в их составе можно выделить такие главнейшие подсистемы: с одной стороны—это биотическое сообщество, а в качестве другой важнейшей подсистемы выступает комплекс абиотических факторов. Интеграция этих подсистем в единую систему осуществляется в результате взаимодействия различных качеств материи (живой и косной). При этом объединить в понятие экосистемы ее качественно различные (живые и неживые) компоненты можно только подчеркнув ту особую роль, которая принадлежит процессам их взаимодействия на основе принципа дополнительности Н. Бора (Радзивилл, 1986а; Депен-чук, Крисаченко, 1986; Гиляров, 1990; Делю, 1990; Емельянов, 1992; Эп-штейн, 1993).
Известно, что постоянные флуктуации среды вызывают адекватные перестройки в структуре видовых популяций, сообществ, биот (Юрцев, 1990), в связи с чем существование той или иной системы в конкретных условиях среды определяется адекватностью ее структуры данным условиям (Мовчан, Семичаевский, 1991; Шеляг-Сосонко и др., 1991). В основе достижения такой адекватности лежат процессы самоорганизации, при этом адаптивные возможности биосистем зависят от их способности накапливать и перерабатывать получаемую го окружающей среды информацию. Степень самоорганизации зависит от структурной сложности биосистем, включающей множественность элементов и разветвленность связей
63
РАЗНООБРАЗИЕ И ФУНКЦИОНАЛЬНАЯ УСТОЙЧИВОСТЬ ЭКОСИСТЕМ
между ними, а также характер взаимодействия элементов по принципу обратных связей, т.е. от их структурно-функциональной организации. В этой связи основной характеристикой биосистем является их относительная стабилизация (устойчивость) — способность к поддержанию и восстановлению своей структуры при ее нарушениях, т.е. способность к саморегуляции (Шмальгаузен, I960, 1960а, 1968; Сетров, 1971; Водопьянов, 1974; Логинов, 1976; Коган, 1977а; Новосельцев, 1978; Николис, Пригожий, 1979; Голубец, 1982, Шедяг-Сосонко и др., 1991; Емельянов, 1992,1994; Голубець, 1997а; Радкевич, 1998 и др.). Следовательно, структурные характеристики биосистем (или отдельных их подсистем) могут выступать в качестве показателей характера действия комплекса абиотических факторов, интенсивности, продолжительности и периодичности их влияния на биосистемы.
Ранее отмечалось (см. главу 2), что в качестве "хранителя информации" у биосистем надорганизменного уровня интеграции могут выступать их структурные характеристики. Следовательно, по особенностям структурной организации биосистем и/или изменениям в структуре их подсистем, можно, по-видимому, судить и о направленности энтропийных процессов в экосистемах в целом. Из этого вытекает важный методологический вывод: характер взаимодействия важнейших подсистем в экосистеме проявляется в виде изменений структурных характеристик подсистем.
Как нами уже обсуждалось, существование биологических систем в переменной среде возможно лишь при условии нахождения их в колебательном режиме, причем биосистемы разного уровня интеграции (от организма до биосферы включительно) являются колебательными системами. В этой связи при рассмотрении функционирования экосистем с позиций системно-структурного подхода следует отметить, что оно основано на взаимодействии (взаимном дополнении) главнейших подсистем в их единстве и противоположности и возможно лишь при гетерогенности экосистемы, т.е. благодаря максимальным отличиям в структурном разнообразии взаимодействующих подсистем (Емельянов, 1990), что обусловлено различной направленностью энтропийных процессов в подсистемах. Последнее обеспечивается существованием постоянных физических барьеров, препятствующих свободному обмену энергией и веществом между биотическим и абиотическим компонентами (Паттен, 1966).
При анализе взаимосвязанных изменений структурных характеристик важнейших подсистем экосистемы необходимо сопоставление энтропийных процессов, происходящих при их взаимодействии. Применение
64
ПРИНЦИП АЛЬТЕРНАТИВНОГО РАЗНООБРАЗИЯ
индекса Шеннона, например, для определения видового разнообразия биотических сообществ предусматривает суммирование вероятностей (нормированных собственным логарифмом) обнаружения представителей каждого вида. Подобный подход к определению содержит кажущееся противоречие, связанное с тем, что наибольшее разнообразие предполагается при одинаковой численности всех видов (максимальной выров-ненности), т. е. при однообразии численностей. Такой взгляд устоялся сегодня в науке.
Следуя логике показателя Шеннона, наибольшая выровненность (соответственно, наименьшая вариабельность) параметров во времени соответствует наибольшему разнообразию факторов, что, не совсем согласуется с привычным представлениями, отождествляющими термины "вариабельность" и "разнообразие" и имеющими место, когда речь идет об абиотических параметрах. Это связано с отсутствием подходов и методов определения разнообразия абиотических факторов. Вариабельность — характеристика, связанная с величиной дисперсии параметров, обратная выровненности. С другой стороны, величина Шенноновской функции разнообразия прямо связана с выровненностыо. В связи с этим применение формулы Шеннона для определения разнообразия абиотических факторов ведет к получению наивысших величин разнообразия в стабильной (невариабельной), выровненной во времени среде.
Этот методический прием приходится применять для обеспечения корректности сравнения разнообразия в обеих главнейших подсистемах экосистем — биотической и абиотической. Понятно, что сегодня анализ разнообразия в абиотическом блоке может быть проведен только на качественном уровне, без выявления количественных аспектов изменения разнообразия абиотических компонентов. Тем не менее и такой анализ, по-видимому, представляет значительный интерес.
Принцип альтернативного разнообразия и его роль в функциональной устойчивости экосистем
Инвариантность структурно-функциональной организации экосистемы во времени проявляется в том, что, находясь в колебательном режиме и испытывая кратковременные изменения структурного разнообразия в одной из главнейших подсистем, система для сохранения своей целостности с помощью управляющих сигналов регулирует структурное разнообразие другой главнейшей подсистемы (или других ее подсистем низших уровней интеграции), причем эти изменения в структуре важней-
65
РАЗНООБРАЗИЕ И ФУНКЦИОНАЛЬНАЯ УСТОЙЧИВОСТЬ ЭКОСИСТЕМ
ъ
пшх подсистем должны быть разнонаправленны (альтернативны). Так, флуктуации абиотических факторов, ведущие к изменению разнообразия в подсистеме абиотических компонентов, вызывают противоположно направленные изменения в разнообразии биотического сообщества или в разнообразии других его компонентов более низкого уровня иерархии (функциональных группировок, или гильдий; отдельных видовых популяций, субпопуляций; различных внутрипопуляционных группировок и т. д.).
Уменьшение или увеличение разнообразия абиотических компонентов должно сопровождаться соответствующими альтернативными изменениями в разнообразии подсистемы биотического блока (рис. 10). При этом механизмы управления разных структурных уровней, очевидно, будут включаться последовательно "снизу вверх" в зависимости от интенсивности и времени действия внешних агентов. Такой характер включения механизмов управления связан с кумулятивным эффектом, т. е. способностью подсистем высших уровней интеграции реагировать не мгновенно, а по мере накопления дозовых воздействий (Мовчан, Семичаевский, 1991), а также со свойственным биосистемам управлением "сверху вниз" и разным порогом чувствительности механизмов координации иерархии контуров управления (Свирежев, 1974; Баевский, Чернышев, 1976; Гаджиев, Чернышев, 1976; Коган, 1977а; Новосельцев, 1978; Конев, 1979; Лекявичюс, 1986; Шишкин, 1987; Гродзинский, 1989 и др.). Между тем, последовательность включения регуляторных механизмов на разных структурных уровнях биотического блока может зависеть от многих причин, в частности, от амплитуды изменений разнообразия в подсистеме абиотических факторов.
Следовательно, изменения в разнообразии биосистем будут проявляться начиная с низших уровней иерархии: на организменном уровне —- в форме изменений биохимических, физиологических и поведенческих реакций (что, несомненно, скажется на интенсивности обменных процессов и уровне энергетического баланса организма), в повышении частоты рекомбинаций и/или мутаций и т.п.; на субпопуляционном уровне — в различном характере формирования колониальных, семейных, генетических и других группировок, их специфическом освоении пространства (распределение по территории и степень агрегированности) и т. п.; на популяционном уровне — в неодинаковой интенсивности процесса рекомбинации и/или мутационного процесса, а также складывающейся в результате этого разной генетической и фенотшшческой структуры по-пуляциц, что влечет за собой и специфический характер экологической
66
ПРИНЦИП АЛЬТЕРНАТИВНОГО РАЗНООБРАЗИЯ
<
s
U x
о
о
X я
lllll
1 -разнообразие
абиотических факторов
2 -разнообразие
бноскстем
Н,>Ш
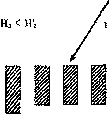
НИИ

Рис. 10. Характер взаимодействия подсистем в экосистеме (схема)
структуры; на уровне биотического сообщества — в изменении состава функциональных группировок, смене доминантов, усложнении или упрощении цепей питания путем выпадения из состава сообщества тех или иных видовых популяций или вселения новых, ранее не встречавшихся видов.
Возможны и изменения разнообразия, охватывающие несколько иерархических уровней подсистем биотического блока. Это должно происходить в тех случаях, когда изменения разнообразия подсистемы низшего уровня иерархии не компенсируют в полной мере флуктуации разнообразия в подсистеме абиотических компонентов. Последнее вынуждает биотическое сообщество для адекватного ответа подключать управляющие механизмы подсистем ряда иерархических уровней одновременно.
67
РАЗНООБРАЗИЕ И ФУНКЦИОНАЛЬНАЯ УСТОЙЧИВОСТЬ ЭКОСИСТЕМ
В качестве примеров альтернативного (противоположно направленного) взаимодействия структурных характеристик важнейших подсистем в экосистемах можно привести теоретическое обоснование характера популяционных приспособлений грызунов к обитанию в условиях стабильного и нестабильного климата по данным наших исследований (Емельянов, 1977, 1978а, 19786; Михалевич, Емельянов, 1977; Емельянов и др., 1978; Межжерин и др., 1991), а также результаты других авторов по полиморфизму популяций различных видов животных, обитающих в неодинаковых условиях (Захаров, 1986; Мандрыка, 1988; Юрцева, 1988; Шайкин, 1990; Казакова, Сергеев, 1992). Эти данные свидетельствуют об увеличении внутрипопуляционного разнообразия и фенологической изменчивости в нестабильных условиях, в том числе и на периферии ареала. Последнее связано с тем, что в центре ареала абиотические условия более стабильны, а значит и разнообразие абиотической компоненты выше, чем на периферии ареала, где резкие колебания величины одного или нескольких факторов приводят к постоянному снижению разнообразия абиотического блока. В соответствии с этим разнообразие биосистем, если не на всех, то на каком-то одном из иерархических уровней подсистем будет изменяться альтернативно.
Еще одним примером альтернативного характера взаимодействия абиотического и биотического блоков в экосистеме могут служить данные А. Мэйна (Main, 1965), показавшего на австралийских бесхвостых амфибиях (Leptodactylidae), что в зонах с постоянным климатом обитают виды, для которых полиморфизм не характерен, тогда как в зонах с меняющимся климатом полиморфные виды обычны. Это может свидетельствовать, по мнению В.Г. Ищенко (1978), о разной экологической ценности отдельных морф и мономорфность видов в зонах с постоянным климатом является следствием отбора в пользу наиболее приспособленных морф. Соглашаясь с выводом В. Г. Ищенко, следует, однако, подчеркнуть, что полиморфизм (повышение разнообразия) можно рассматривать как альтернативную реакцию биосистем популяционного уровня интеграции в ответ на уменьшение разнообразия абиотического блока.
С подобной реакцией биотического сообщества на снижение разнообразия абиотических факторов можно, очевидно, связать и отмеченное Р. Уиттекером (1980) увеличение видового разнообразия растений в условиях нестабильного климата, в то время как в стабильной физической среде даже в старых сообществах видовое разнообразие снижается, причем уменьшение разнообразия, как отмечает Ю. Одум (1986а), происходит за счет повышения межвидовой конкуренции. С позиций противопо-
68
ПРИНЦИП АЛЬТЕРНАТИВНОГО РАЗНООБРАЗИЯ
ложно направленного энергетически-информационного взаимодействия абиотического и биотического блоков в экосистемах можно объяснить отмеченный А. А. Ляпуновым (1964) полиморфизм синузий (функциональных группировок биоценозов) в условиях значительных флуктуации проходящего через экосистемы энергетического потока, тогда как при стабилизации этого потока, как указывает автор, синузий оказываются в условиях стабилизирующего отбора, что, ведет, вероятно, к снижению полиморфизма и в целом к уменьшению разнообразия функциональных группировок биоты. Последним можно объяснить и отмеченное нами уменьшение видового богатства сообществ грызунов с продвижением в горы (Емельянов, Загороднюк, 1993; Загороднюкидр., 1995; Емельянов и др., 1999; см. главу 2).
Особую роль "экологических колебаний" (колебаний абиотических факторов) в поддержании фенотипического разнообразия популяций организмов отмечают А. Н. Горбань, Р. Г. Хлебопрос (1988). На наличие положительной корреляции между полиморфизмом в популяциях живых организмов и вариабельностью среды указывают и другие авторы (Синская, 1939; Шварц, 1967; Dobzhansky, 1970; Аверьянова, 1972; Кампшлов, 1973; Nevo, 1973, 1978; Milsteadetal., 1974; Шилов, 1977; Левонтин, 1978; Гер-шензон, 1979; Айала, 1981; Лекявичюс, 1986; Семериков, 1987; Черепанов, 1987 и др.). В частности, И. Г. Казаковой и М. Г. Сергеевым (1992) при изучении пространственной организации популяционнои системы вида у короткокрылого конька Chorthippus parallelus Zett. (Insecta: Orthoptera) на представительном материале было установлено, что наибольшее фе-нетическое разнообразие наблюдается в популяциях этих насекомых, встречающихся у периферии ареала вида. Такой феномен авторы связывают с возможной временной нестабильностью параметров среды в этих условиях (Левонтин, 1978). Повышение фенотипического разнообразия в популяциях при увеличении нестабильности среды характерно и при математическом моделировании биоразнообразия (Алещенко, Букварева, 1991).
Если крайние значения какого-либо из параметров среды, как отмечает Э. Лекявичюс (1986), наблюдаются длительное время, это может закончиться превращением мономорфной популяции в полиморфную. Такой же эффект будет наблюдаться при перманентных колебаниях нескольких факторов, что уменьшает разнообразие абиотического блока, при этом постоянные изменения направления отбора и его интенсивности препятствуют закреплению преимуществ при репродукции за одной из морф. Это приводит в конечном счете к неизбирательной элиминации и выполнению равновесия Харди-Вайнберга (Четвериков, 1926; Межжерин, 1975;
69
РАЗНООБРАЗИЕ И ФУНКЦИОНАЛЬНАЯ УСТОЙЧИВОСТЬ ЭКОСИСТЕМ
Ъ
Ушаков и др., 1977; Михалевич, Емельянов, 1977; Лекявичюс, 1986), что. в свою очередь, обеспечивает поддержание высокого уровня внутрипо-пушщионного полиморфизма и фенотипического разнообразия (Емельянов и др., 1978; Межжерин и др., 1991).
Сохранение множественных аллелей в популяции, по мнению Ф. X. Айалы (1981), может обусловливаться прямым действием отбора. В частности, это наблюдается в условиях неоднородности (вариабельности) среды, когда естественный отбор благоприятствует разнообразию генофонда, для того чтобы в нем имелось несколько аллелей, адаптированных к тем или иным конкретным условиям. Так, проведенные исследования (Айала, 1981) показали, что различные варианты ферментов (кодируемые разными аллелями) могут отличаться по своей каталитической активности, по чувствительности к температуре и рН среды, по своим реакциям на другие факторы, вследствие чего они подвергаются действию отбора. Действительно, оказалось, что в популяциях плодовой мушки (Drosophila melanogaster) некоторые варианты фермента алкогольдегид-рогеназы более теплоустойчивы по сравнению с другими вариантами, они чаще встречаются в популяциях, обитающих в более теплых районах. Это позволило сделать вывод, что "сохранение множественных аллелей в некоторых локусах, возможно, обеспечивается "диверсифицирующим" (увеличивающим разнообразие) отбором, происходящим в популяциях, обитающих в неоднородных средах" (Айала, 1981; с. 53).
Альтернативный (противоположно направленный) характер взаимодействия абиотического и биотического блоков наблюдается и в экото-нах — пограничных зонах крупных ландшафтно-экосистемных подразделений, обычно возникающих при контакте двух или нескольких экосистем и представляющих собой переходное между другими четко различающимися сообществами пространственно ограниченное сообщество живых организмов (Одум, 1975, 1986а; Пианка, 1981; Харченко, 1991). Здесь на фоне постоянно меняющихся условий среды (уменьшающих разнообразие абиотических факторов) наблюдается получившее название "краевого эффекта" (Одум, 1975, 1986а) повышение видового разнообразия сообществ по сравнению с таковым контактирующих экосистем (Красилов, 1972; Гиляров, Маркина, 1976), а также более высокое внут-рипопуляционное разнообразие различных видов организмов.
Более детально хотелось бы остановиться на результатах, полученных нами на основании материалов В. В. Полищука (1991), где приведены данные по структуре зоопланктона озера Нобель (Припятское Полесье). Проведенный расчет индекса Шеннона для зоопланктона в разных участках
70
ПРИНЦИП АЛЬТЕРНАТИВНОГО РАЗНООБРАЗИЯ
озера (табл. 6, 7) показал, что видовое разнообразие зоопланктона пела-гиали было и по численности, и по биомассе значительно ниже, чем в литорали (соответственно — 3,505; 2,396 и 4,323; 2,963). И это несмотря на более высокую суммарную плотность по численности и биомассе приведенных в таблицах видов: для пелагиали — соответственно 16417 экз./ м3 и 556,18 мг/м3, для литорали — 6388 экз./м3 и 385,10 мг/м3. По каким-то причинам в пробах зоопланктона пелагической части озера (табл. 6) оказались бентосные формы. При исключении их из анализа и повторном расчете индекса Шеннона для типичных видов-зоопланктеров пелагиали (табл. 8) были получены еще большие отличия в видовом разнообразии зоопланктона пелагиали и литорали (и по численности, и по биомассе различия достоверны— р< 0,001).
По мнению В.В. Полищука, в воронке оз. Нобель разгружаются напорные подземные воды, что создает в нем определенное постоянство абиотических условий. Последнее, по-видимому, обусловливает не только большую экологическую емкость пелагиали, о чем свидетельствуют и высокие величины плотности всего зоопланктона (см. табл. 6-8), но и значительное разнообразие компонентов абиотического блока в этой части водоема. Напротив, в прибрежных частях (литорали) колебания тех или иных абиотических факторов более значительны, что ведет к уменьшению разнообразия в подсистеме абиотических компонентов. В этих условиях следует ожидать соответствующей реакции биотического сообщества на изменение разнообразия абиотических факторов. В связи с тем, что при переходе от пелагиали к литорали разнообразие в подсистеме абиотического блока экосистемы уменьшается, сообщества организмов в литорали должны увеличивать свое структурное разнообразие по сравнению с таковым пелагиали, что и подтверждается результатами проведенного анализа.
Это же касается и характера антропогенного воздействия на популяции разных видов живых организмов и биотические сообщества.
Антропические факторы (факторы, обусловленные хозяйственной деятельностью человека), входя в подсистему абиотических компонентов, в целом увеличивают ее разнообразие, причем, чем большее количество факторов включаются в этот блок одной из важнейших подсистем экосистемы, тем выше его разнообразие (так как с ростом числа элементов, как уже отмечалось, разнообразие возрастает). Следовательно, чем большее число антропических факторов оказывает воздействие на биотическое сообщество и чем более они выровнены (т. е. амплитуда их колебаний относительно невелика), тем меньшее разнообразие должно наблю-
71
РАЗНООБРАЗИЕ И ФУНКЦИОНАЛЬНАЯ УСТОЙЧИВОСТЬ ЭКОСИСТЕМ
Таблица 6. Структура зоопланктона пелагиали оз. Нобель (по даввым В. В. Полищука, 1991).
Организмы |
Средни численность, ЭКЗ./М3 |
Биомасса, мг/м3 |
1 |
2 |
3 |
Diaptomus coeruleus (Fischer) |
5061 |
328,970 |
Thermocyclops crassus (Fischer) |
1858 |
46,450 |
Sida crystallina (Muter) |
91 |
54,430 |
Daphnia cucullata Sars |
715 |
29,230 |
Bosmina longirostris (Muller) |
2719 27,190 |
|
Mesocyclops leuckarti (Ctaus) |
368 |
14,680 |
Diaphanosoma brachyunim (Lievin) |
243 |
8,500 |
Chydorus sphaencus (Muller) |
878 8,780 |
|
Acanthocyclops vernalis (Fscbsr) |
100 |
5,000 |
Bosmina coregoni Baird. |
190 |
1.900 |
Stylaria ktcusMs (L.) |
34 |
3,340 |
Ceriodaphnia affinis LiBj. |
270 |
2,700 |
Monospilus dispar Sars |
243 |
3,150 |
Cricotopus sitvestris Fabr. |
67 |
1,670 |
Synchaeta oblonga Ehr. |
1864 |
1,492 |
Microcyclops varicans Sars |
86 |
3,000 |
Acropems harpae (Baird.) |
30 |
1,200 |
Asplanchna priodonia Gosse |
71 |
1,430 |
Polyphemus pediculus (L.) |
17 |
1,710 |
Limnocylhere inopirtata (Baird.) |
5 |
2,500 |
Attheyella crassa (Sars) |
22 0,520 |
|
Rhynchotalona rostrata (Koch.) |
57 |
1,140 |
Rh. fakata (Sars) |
33 |
0,660 |
Pleuroxus trigonellus (Mulier) |
15 1,140 |
|
Dolerocypris fascicaa (Muller) |
3 ! 1,500 |
|
Alona quadrangularis (Mulfer) |
47 |
0,540 |
Pleuroxus strialus (Schoedier) |
35 |
1,029 |
Habrotmcha bidens (Gosse) |
21 |
0,263 |
Alona reclangula Sars |
10 |
0,350 |
72
ПРИНЦИП АЛЬТЕРНАТИВНОГО РАЗНООБРАЗИЯ
Продолжение таблицы 6.
1 2 , |
3 J |
Aionelia папа Brehm 49 |
0,200 |
Chydorus gibbus Sars ; 27 |
0,290 |
Tobrilus stefanskn (Micol) 9 |
0,19 |
Alona affinis (Leydig) i 5 |
0,25 |
Chydorus globosits (Baird.) ; 28 |
0,36 |
Polyarthra major Burckhardt 143 |
0.053 |
Brachionus anguiaris Gosse \ 214 |
0,086 |
Euchlanis dilatata lucksiana Hauer 20 |
0,057 |
Ascomorpha agilis Zacharias i 210 |
0,053 |
Alona costata Sars 7 |
0,041 |
Centropyxis acukata Stein 194 |
0,009 |
Habrotrocha lota (Bryce) i 5 |
0,02 |
Conochilus unicornis Roussetet 7 |
0,014 |
Difflugia oblonga longicolhs Gassovskj 143 |
0,01 |
Keratdla quadrat a (Midler) 14 |
0,008 |
Rot aria socialis Kefficott 14 |
0,013 |
Arcella discoides scutelliformis Play&ir 35 |
0,003 |
Adineta barbata Janson 14 |
0,006 |
f^ecane luna (Mufler) 12 |
0,004 |
Arcella discoides pseudovulgaris Deflandre 34 |
0,007 |
Lecane rhenana Hauer 29 |
0,009 |
Tobrilus longus (Lekly) 4 |
0,009 |
Habrothrocha rosa Domer 7 |
0,007 |
Alona protzi Hartwig | 3 |
0,01 |
Cephafodetta eva (Gosse) 14 |
0,004 |
Tnchocerca bidens (Lucks) 5 |
0,001 |
Dipleuchlanis pmpatula (Gosse) , 3 |
0,001 |
Centropyxis platystoma Penard 15 |
0,001 |
Плотность ! 80176 |
998,52 |
Суммарная плотность приведенных компонен Г 64 17 |
556,180 |
тов зоопланктона |
|
Индекс Шеннона (Н) 3,505 |
2,396 |
(S.) 0,023 |
0,003 |
РАЗНООБРАЗИЕ И ФУНКЦИОНАЛЬНАЯ УСТОЙЧИВОСТЬ ЭКОСИСТЕМ
Таблица 7. Структура зоопланктона литорали оз. Нобель (по данным В. В. Полищука, 1991).
Организмы |
Средняя численность, экз./м3 |
Биомасса, мг/м3 |
1 |
2 |
3 |
Sida crystaUina (MuDer) |
250 150 |
|
Eudiaptomus coeruleus (Fischer) |
373 |
117,7 |
Bosmina bngirostris (Muter) |
1580 |
15,8 |
Thermocyclops crassus (Fischer) |
310 |
7,75 |
Diaphanosoma brachyurum (Lievin) |
206 |
8,21 |
Mesocychps leuckarti (Glaus) |
200 |
8 |
Daphnia cucullata Sars |
172 |
4,98 |
Polyphemus pediculus (L.) |
100 |
8 |
Chaetogaster diastrophus (Gruith-) |
160 |
8 |
Cryptochironomus defectus (Kieff) |
8 |
7,5 |
Eucyclops serrulalus (Fischer) |
100 |
3 |
Acroperus harpae (Baird.) |
100 |
4 |
Monospilus dispar Sars |
222 |
3,22 |
Eucyclops macruroides (Lij.) |
80 |
3,6 |
Cricoiopus silveslris Fabr. |
70 |
5 |
Nitocra hibermca (Brady) |
65 |
1,63 |
Alona intermedia Sars |
140 |
1,94 |
Diacyclops bicuspidatus odessana (Schmank.) |
120 |
4,2 |
Euchlanis dilatata lucksiana Hauer |
502 |
1,5 |
Cypridopsis vidua (Mufler) |
5 |
2,5 |
Metacyclops planus (Oumey) |
108 |
2,1 |
Tobrihts longus (Leidy) |
74 |
0,7 |
Chydorus sphaericiis (MuDer) |
ПО |
1,1 |
Cricotopus algarum Kieffi |
5 |
2,5 |
Pieuroxus trigonellus (MuDer) |
30 |
0,9 |
Rhynchotalona rostrata (Koch.) |
100 |
1 |
Stylaha lacustris (L.) |
48 |
1,2 |
74
ПРИНЦИП АЛЬТЕРНАТИВНОГО РАЗНООБРАЗИЯ
Продолжение таблицы 7.
1 |
2 |
3 |
Asplanchna priodonta Gosse |
61 |
1,09 |
Tubifex tubifex (Mulfcr) |
4 |
2,6 |
Centropyxis discoides Penard |
420 |
0,2 |
Nais barbata Mufer |
45 |
0,8 |
Euchlanis lyra Hudson |
300 |
0,75 |
Dorylaimus helveticus Stei |
20 |
1 |
Pieuroxus aduncus (Jurine) |
20 |
0,6 |
Ceriodaphnia pulchella Sars |
20 |
0,6 |
Khynchotalona falcata (Зав) |
20 |
0,2 |
Ceriodaphnia affinis Lfflj. |
28 |
0,3 |
Chydorus gibbus Sars |
24 |
0,28 |
Bosmina coregoni Baird. |
20 |
0,2 |
Attheyella crassa (Sars) |
12 |
0,24 |
Euchlanis dilatata HIT. |
156 |
0,21 |
Плотность |
34198 |
868,9 |
Суммарная плотность приведенных |
6388 |
385,10 |
компонентов зоопланктона |
|
|
Индекс Шеннона (Н) |
4,323 |
2,963 |
(§„) |
0,043 | 0,015 |
|
даться в подсистеме биотических компонентов (на всех, на нескольких или на каком-то одном из иерархических уровней).
В качестве примера приведем обобщающую работу А.Ф. Алимова (1990), где обсуждаются результаты многих гидробиологических исследований, согласно которым при антропогенном евтрофировании и загрязнении водоемов деструктивные процессы в биотических сообществах резко возрастают: сокращается число видов, становится более выраженным доминирование отдельных видов. В олиготрофных условиях в незагрязненных водоемах, как отмечает А. Ф. Алимов, напротив, разнообразие сообществ высокое, доминирование отдельных вадов менее выражено. Это и понятно, так как в первом случае число факторов абиотического блока резко возрастает, что приводит к увеличению разнообразия абиотических компонентов и, соответственно, к альтернативному уменьшению разнообразия биотических сообществ; а во втором, наоборот, раз-
75
РАЗНООБРАЗИЕ И ФУНКЦИОНАЛЬНАЯ УСТОЙЧИВОСТЬ ЭКОСИСТЕМ Таблица 8. Структура зоопланктона пелагиали оз. Нобель
Организмы |
Средняя численность, ЭКЗ./М3 |
Биомасса, мг/м3 |
1 |
2 |
3 |
Diaptomus coeru/eus (Fischer) |
5061 |
328,97 |
Thermocydops crassus (Fischer) |
1858 |
46,45 |
Daphnia cucullata Sars |
715 |
29,23 |
Bosmina longimstris (Mulfer) |
2719 |
27,19 |
Mesocyclops leuckarti (Claus) |
368 |
14,68 |
Diaphanosoma brachyurum (Lievin) |
243 |
8,5 |
Bosmina coregoni Baird. |
190 |
1,9 |
Ceriodaphnia affinis Lfflj. |
270 |
2,7 |
Monospilus dispar Sars |
243 |
3,15 |
Cricotopus silvestris Fabr. |
67 |
1,67 |
Synchaeta oblonga Ehr. |
1864 |
1,492 |
Acroperus harpae (Bard.) |
30 |
1,2 |
Asplanchna pnodanta Gosse |
71 |
1,43 |
Polyphemus pediculus (L.) |
17 |
1,71 |
Rhynchotalona rostrata (Koch.) |
57 |
1,14 |
Rh.falcata (Sars) |
33 |
0,66 |
Pleuroxus Irigonellus (MuDer) |
15 |
1,14 |
Alona quadrangularis (Mulfcr) |
47 |
0,54 |
Habrotrocha bidens (Gosse) |
21 |
0,263 |
Alona rectangula Sars |
10 |
0,35 |
AloneUa папа Brehm |
49 |
0,2 |
Alona affinis (Leyd^) |
5 |
0,25 |
Polyarthra major Burckhardt |
143 |
0,053 |
Brachionus angularis Gosse |
214 |
0,086 |
Euchlanis dilatata lucksiana Hauer |
20 |
0,057 |
Ascomorpha agihs Zacharias |
210 |
0,053 |
Alona costata Sars |
7 |
0,041 |
Habrotmcha lata (Br)ce) |
5 |
0,020 |
76
ПРИНЦИП АЛЬТЕРНАТИВНОГО РАЗНООБРАЗИЯ
Продолжение таблицы 8.
1 |
2 |
3 |
Conochilus unicornis Roussefet |
7 |
0,014 |
Keratella quadrata (Mufler) |
14 |
0,008 |
Rotaria socialis Kefficott |
14 |
0,013 |
Adineta barbata Janson |
14 |
0,006 |
Lecane luna (Mulfer) • 12 |
0,004 |
|
Lecane rhenana Hauer |
29 |
0,009 |
Habrothrocha rosa Domer |
7 |
0,007 |
Alona protzi Hartwig ' 3 |
0,01 |
|
CephalodeUa eva (Gosse) |
14 |
0,004 |
Trichocerca bidens (Lucks) |
5 |
0,001 |
Dipleuchlanis propatula (Gosse) |
3 |
0,001 |
Плотность |
34198 |
868,9 |
Суммарная плотность приведенных |
14674 |
475,202 |
компонентов зоопланктона |
|
|
Индекс Шеннона (Н) |
3,054 |
1,792 |
(s_> |
0,021 |
0,003 |
нообразие сообществ увеличивается вследствие снижения разнообразия в подсистеме абиотического блока.
Действительно, данные по структуре фитопланктона в отдельных водоемах (в частности, в Запорожском водохранилище) свидетельствуют, что в условно чистых водах наблюдаются высокие и стабильные значения индекса Шеннона, тогда как в районах поступления сточных вод металлургической промышленности (где разнообразие абиотического блока за счет загрязняющих веществ повышается) сообщество фитопланктона деградировано, отмечено значительное уменьшение его разнообразия (Мисюра, Емец, 1990).
Аналогичные результаты были получены при учете птиц водно-болотного комплекса в русловой части Нижнего и Среднего Дуная (Акимов и др., 1993). Известно, что птицы могут служить индикатором экологического состояния окружающей среды. Поэтому ухудшение качества воды в водоеме, приводящее к изменению качественных и количественных характеристик продуцентов (водорослей, высшей водной растительности), может, в свою очередь, обусловливать и иной характер структурной организации живых организмов последующих звеньев трофической цепи (зоопланктона, моллюсков, рыб, земноводных, птиц). Так, данные уче-
77
РАЗНООБРАЗИЕ И ФУНКЦИОНАЛЬНАЯ УСТОЙЧИВОСТЬ ЭКОСИСТЕМ
тов, проведенных А. М. Полудой и В. И. Крыжановским (табл. 9), свидетельствуют о том, что, несмотря на большее количество видов птиц и значительно более высокую их суммарную численность на нижнем участке реки по сравнению со средним участком водотока, видовое разнооб-
Таблица 9. Распределение птиц водно-болотного комплекса по данным учетов в русловой части Нижнего и Среднего Дуная (по данным И. А. Акимова ссоавт., 1993)
Виды |
Количество учтенных птиц |
||
Нижний Дунай |
Средний Дунай |
Всего |
|
1 |
2 |
3 |
4 |
Чомга - Podiceps cristatus (L.) |
- |
13 |
13 |
Серошекая поганка - Podiceps griseigena (Bodd) |
- |
30 |
30 |
Черношеяя поганка - Podiceps nigricollis (Biehm) |
- |
2 |
2 |
Большой баклан - Phalactvcorax carbo (L.) |
27936 |
4240 |
32176 |
Малый баклан - Phatacrocorax pygmaeus (Рай) |
124 |
15 |
139 |
Серая цапля - Ardea cimrea (L.) |
374 |
385 |
759 |
Большая белая цапля - Egrelta alba (L.) |
42 |
122 |
164 |
Малая белая цапля - Egretta garzetta (L.) |
10 |
- |
10 |
Кваква - Nycticorax nycticorax (L.) |
140 |
- |
140 |
Розовый пеликан - Pelecarrus onocrotalus (L.) |
4 |
- |
4 |
1 Лебедь-шипун - Cygmts olor (Gm.) Серый гусь - Anser anser (L.) Кряква - Anas platyrhynehos (L.) |
500 31020 |
15 8295 |
15 500 39315 |
+ (дельта Дуная) |
16500 |
- |
16500 |
Чирок- трескунок - Anas qurquedula (L.) |
210 |
215 |
425 |
Свиязь - Anas penelape (L.) |
— |
2 |
2 |
Серая утка - Anas strepera (L.) |
|
3 |
3 |
Красноголовый нырок - Aythyaferina (L.) |
405 |
40 |
445 |
Скопа - Pandion haliaetus (L.) |
1 |
1 |
2 |
Лысуха - Fulica atra (L.) |
1000 |
3400 |
4400 |
Чибис - Vaneuus vanettus (L.) |
120 |
- |
120 |
|
35 |
- |
35 |
Тулес - Squatarola squatamla (L.) |
1 |
- j 1 |
|
78
Продолжение таблицы 9.
Чернозобик - Calidris alpina (L.) |
- |
20 |
20 |
Озерная чайка - LOTUS ridibundus (L.) |
21970 |
5265 |
27235 |
Серебристая чайка - Larus argentatus (Pontopp.) |
1365 |
3390 |
4755 |
Сизая чайка - Larus canus (L.) |
830 |
145 |
975 |
Речная крачка - Sterna hirundo (L.) |
30 |
- |
30 |
Всего: количество видов |
20 |
19 |
27 |
число учтенных птиц |
102617 |
25598 |
128215 |
Индекс Шеннона (Н) <SH) |
• 1,872 0,005 |
2,483 0,010 |
;2,085 0,005 |
разие орнитокомплексов, однако, оказывается значительно выше в среднем течении Дуная (различия достоверны — р < 0,001). Последнее может свидетельствовать о повышении разнообразия в блоке абиотических компонентов в нижнем течении реки, где антропогенная нагрузка на этот водоток резко возрастает (увеличивается количество ингредиентов в результате сброса отходов промышленных предприятий и сельскохозяйственного производства), что подтверждается и данными анализа качества воды исследуемых участков реки (Михайленко та ш., 1991).
На снижение видового разнообразия гидробионтов в результате загрязнения Хаджибейского лимана указывал С. В. Воловникссоавт. (1990). Другими исследователями, к примеру, было установлено, что возрастающая антропогенная трансформация экосистем Иссык-Кульской котловины ведет к значительному обеднению видового и типового разнообразия биоценозов (Конурбаев и др., 1990).
Что же касается наземных экосистем, то известно, что биотические сообщества, локализованные в наиболее нарушенных деятельностью человека биотопах, характеризуются пространственно-временной гомогенизацией основных компонентов биоты, значительным убожеством видов, резким снижением индекса разнообразия отдельных групп живых организмов (Исаков и др., 1986; Dyduch-Falniowska, Fyda, 1986; Базиле-вич и др., 1987; Мауринь и др., 1989; Бурда, 1990 и др.). Так, например, установлено, что при внесении комплексных минеральных удобрений в пойменных биоценозах уже в первые десять лет происходит полная их трансформация: флористический состав сокращается почти вдвое, суще-
79
РАЗНООБРАЗИЕ И ФУНКЦИОНАЛЬНАЯ УСТОЙЧИВОСТЬ ЭКОСИСТЕМ
ствеюю упрощается флористическая структура; полидоминантные флористически богатые фитоценозы сменяются моно- и дидоминантными, флористически бедными; почти вдвое сокращается число семейств и спектр жизненных форм; биомасса видов-доминантов достигает 80-85 % (90 %) общей биомассы всех растений на единицу площади. Упрощение структуры фитоценозов обусловливает изменение видового состава и численности энтомофауны, при этом снижается разнообразие генотипов в популяциях насекомых (Егорова, Курченко, 1990). Аналогичные изменения наблюдаются в структуре орнитономплексов — резкое снижение видового разнообразия (при уменьшении количества видов и ярко выраженном доминировании нескольких видов) отмечено при сплошном сельскохозяйственном освоении или урбанизации территорий (Константинов и др., 1990). На обеднение флористического разнообразия растительных сообществ при рекреационных воздействиях на экосистемы указываете. П. Се-ледец (1991).
Уменьшение внутрипопуляционного разнообразия организмов в результате антропогенного воздействия отмечено и нами. Так, для животных, обитающих в условиях нестабильного климата, как уже отмечалось, в целом свойствен значительный фенотипический полиморфизм. Однако в этих же условиях в агроценозах, где разнообразие в абиотическом блоке повышается за счет добавления ряда антропических факторов, связанных с хозяйственной деятельностью, население грызунов более моно-морфно по сравнению с популяцией, обитающей в естественной экосистеме (Емельянов, 1978, 1979, 1988; Емельянов и др., 1978; Межжерин и ДР-, 1991).
На уменьшение видового разнообразия сообществ и генетического разнообразия видовых популяций организмов,, происходящее вследствие интенсивной хозяйственной деятельности человека, указывает Ю. Одум (1986а), а на упрощение структуры экосистем и ослабление их способности к регуляции в результате суммарного эффекта естественных и антропических факторов — Дж. Вудвелл (1972).
Р. Уиттекер (1980), отмечая, что загрязнение среды обычно сокращает видовое разнообразие, тем не менее связывает этот феномен с элиминацией наиболее чувствительных к стрессам видов, а не с реакцией сообщества как целого на изменения условий среды. Нам представляется такая точка зрения односторонней. За исключением тех случаев, когда действительно один или несколько из многих абиотических факторов (в том числе и антропических) достигают экстремальных значений, являющихся летальными для того или иного вида или сообщества в целом (по-
80
ПРИНЦИП АЛЬТЕРНАТИВНОГО РАЗНООБРАЗИЕ
жары, ураганы, наводнения, извержения вулканов, высокие дозы радиации и т. п.), в пределах толерантности живых организмов реакция их на изменения величины тех или иных абиотических факторов, а также комплекса факторов будет различной. Это касается не только видовых популяций, входящих в биотическое сообщество, но и сообщества в целом как одного из высших уровней организации живого.
Таким образом, приведенные примеры свидетельствуют о том, что повышение разнообразия в подсистеме абиотических компонентов вызывает противоположно направленную реакцию в структуре биотического сообщества — разнообразие на тех или иных иерархических уровнях подсистемы биотического блока уменьшается.
Некоторые исследователи делают попытки определить критический уровень видового разнообразия биотических сообществ для отдельных регионов (см., например, работу Р. И. Бурды (1990), указывающей в качестве критического уровня флористического разнообразия для флор-изо-лятов юга-востока Украины наличие 350-400 видов. Обеднение видового состава ниже этой цифры, по мнению автора, связано с нарушением в таксономической, экологической, фитоценотической структуре флоре-изолята).
Отдельно целесообразно проанализировать характер антропогенного воздействия, когда значения одного или нескольких антропических факторов достигают значительных величин. В этих условиях, как уже отмечалось, разнообразие абиотического блока заметно снижается, что должно вызывать альтернативную реакцию в разнообразии подсистемы биотических компонентов. Как свидетельствуют данные некоторых исследователей, такая картина имеет место в действительности. Так, например, в популяциях животных, обитающих в биотопах, где концентрация промышленных выбросов очень велика (что уменьшает разнообразие абиотического блока), наблюдается более высокий уровень фенотипической вариабельности по сравнению с популяциями из менее загрязненных биотопов (Батлуцкая, 1990).
Анализ результатов, полученных многими исследователями при изучении влияния аварии на Чернобыльской АЭС на живые организмы, позволил проверить справедливость развиваемых нами положений. Так, было установлено, что в зоне ЧАЭС наблюдается увеличение частоты мутаций и хромосомных аберраций у различных видов растений и животных (Каль-ченко и др., 1989; Козубов и др., 1989; Пастернак и др., 1989; Федотов и др., 1989; Дмитриева, 1990; Духарев и др., 1990; Крысанов, Крысанова,
81
РАЗНООБРАЗИЕ И ФУНКЦИОНАЛЬНАЯ УСТОЙЧИВОСТЬ ЭКОСИСТЕМ
1990; Нилова и др., 1990; Рождественская и др., 1990; Шевченко и др., 1990; Шевченко, 1991), а также у людей, подвергшихся облучению (Елисеева и др., 1990; Мазник, 1990; Шевченко, Акаева и др., 1990). Кроме того, отмечено повышение частоты редких фенов и в целом увеличение фенотипической изменчивости и внутрипопуляционного разнообразия у насекомых (Титар, 1990,1990а; Титар и др., 1990) и грызунов (Крапивко, Ильенко, 1990). Особо следует обратить внимание на то обстоятельство, что повышение частоты мутаций и хромосомных аберраций наблюдалось по мере возрастания мощности дозы облучения. Имеются данные, свидетельствующие о том, что при повышении радиоактивного загрязнения местности наблюдается увеличение изменчивости в размерах и в окраске яиц у птиц (Кусенков, 1993).
Такая же картина характерна и для внутрипопуляционного разнообразия фонетической структуры популяций насекомых — число фенов и их выровненность увеличивается по градиенту возрастания мощности дозы. И это вполне понятно, так как в центральной части зоны благодаря высокому значению одного фактора (радиация) разнообразие абиотического блока минимально, что влечет за собой альтернативное изменение (увеличение) разнообразия в подсистеме биотического блока. По мере удаления от центра к периферии зоны величина радиация уменьшается, что ведет к возрастанию разнообразия комплекса абиотических факторов и к соответствующему снижению разнообразия в иерархической структуре подсистемы биотического блока.
К аналогичным выводам, по-видимому, можно прийти при рассмотрении структуры биотических сообществ, разнообразие которых в зоне выше, чем за ее пределами. По мнению многих исследователей, это связано не столько с радиоактивным загрязнением местности, сколько со вторичными радиоэкологическими факторами: сокращением хозяйственной деятельности человека, отсутствием фактора беспокойства и т. п.
Действительно, "вторичные радиоэкологические факторы", а вернее —уменьшение числа антропических факторов, входящих в подсистему абиотического блока, наряду со значительной величиной радиационного фактора, обусловливает резкое снижение разнообразия в абиотической компоненте экосистемы. Последнее должно приводить к увеличению разнообразия в подсистеме биотического блока. А так как, по-видимому, изменение разнообразия в подсистеме абиотических факторов довольно значительное, то и соответствующая реакция биотического сообщества с неизбежностью должна затрагивать высший уровень иерархии этой под-
82
ПРИНЦИП АЛЬТЕРНАТИВНОГО РАЗНООБРАЗИЯ
системы (видовое разнообразие биотического сообщества). Очевидно, это и имеет место в действительности. Несмотря на отсутствие расчетов индекса Шеннона в самих работах и невозможностью произвести расчет по материалам публикаций, можно, тем не менее, говорить о повышении видового разнообразия биотических сообществ в целом, основываясь на полученных авторами результатах в отношении увеличения количества видов и выровненности их численности для энтомокомплексов, орнито-комплексов и териокомплексов (Васильченко и др., 1989; Габер, Саби-невский, 1990; Гайченко и др., 1990; Стовбчатый, Петренко, 1990; Суще-ня и др., 1990), а также фаунистических комплексов паразитических организмов (Лабецкая и др., 1990).
Рассмотренные выше теоретические положения, подтвержденные многочисленными экспериментальными данными, позволяют заключить, что в основе структурно-функциональной организации экосистем лежит "принцип альтернативного разнообразия": функциональная устойчивость системы обусловлена компенсаторным альтернативным изменением разнообразия в структуре взаимодействующих подсистем (Емельянов, 1992). Таким образом, любое изменение разнообразия в структуре управляющей подсистемы будет вызывать противоположно направленное изменение разнообразия в управляемой (ых) подсистеме (ах).
Механизмы, с помощью которых осуществляется регуляция, охватывают различные уровни организации живого (от молекулярно-гене-тического до биосферного), включаясь последовательно "снизу вверх" в зависимости от амплитуды колебаний разнообразия в управляющей подсистеме, и обеспечивают компенсаторные изменения разнообразия в структуре биосистем в ответ на изменение разнообразия абиотических факторов. Это позволяет биосистемам сохранять устойчивость во времени не только в процессе колебательного режима, но и в гораздо более значительных временных интервалах (в ходе сукцессии экосистем и их эволюции).
Выше уже отмечалось, что сукцессия биотических сообществ направлена на достижение максимальной сложности своей структуры в пределах, допускаемых условиями среды. При этом процесс усложнения заключается не только в увеличении числа компонентов и их выровненности (т.е. в повышении видового разнообразия), но и в возрастании разнообразия структуры сообщества благодаря усложнению пищевой цепи (трофической сети), или в увеличении разнообразия путем усложнения горизонтальной и вертикальной структурированности ("многомерная структурированность"). Примерами такой многомерной структурированности
83
РАЗНООБРАЗИЕ И ФУНКЦИОНАЛЬНАЯ УСТОЙЧИВОСТЬ ЭКОСИСТЕМ
в сообществах может сложить ярусно-биотопическая и пространственно-временная дифференциация отдельных видовых популяций животных, гильдийная структурированность по Р. Уиттекеру (1980), а также альфа-разнообразие (разнообразие внутри местообитаний или внутри сообщества) (Уиттекер, 1980; Песенко, 1982; Одум, 1986а; Джиллер, 1988; Чернов, 1991). Для более крупных ландшафтно-экосистемных подразделений обычно выделяют бета-разнообразие (разнообразие местообитаний), а также гамма-разнообразие (общее разнообразие) — для оценки разнообразия в обширных регионах биома, континента, острова и т. д. (Уиттекер, 1980; Песенко, 1982; Одум, 1986а; Джиллер, 1988; Чернов, 1991).
К такому же порядку явлений можно отнести и обсужденные нами результаты, полученные при оценке степени сложности биотических сообществ в конкретных условиях среды (подробнее см. главу 2; рис. 9). В частности, на примере сообществ грызунов Восточных Карпат было показано, что в условиях ограниченности ресурсов (невысокой емкости экосистем) и вследствие этого — уменьшения видового богатства и таксономической сложности сообществ, их устойчивость может поддерживаться за счет компенсированного повышения качественного разнообразия, отражающего сложность взаимодействий между различными компонентами сообщества. Как указывалось ранее, возможное объяснение этого феномена заключается в том, что экосистемы предгорья характеризуются большей экологической емкостью по сравнению с горными местообитаниями, в результате чего здесь реализуется более широкая "комбинативная система экологических ниш" (Шварц, Замолодчиков, 1991). Однако в свете сформулированного нами принципа альтернативного разнообразия, можно говорить и о том, что в горных условиях абиотические факторы более стабильны в сравнении с равниной, а значит иразнообразие абиотической компоненты выше, чем в предгорных экосистемах, где резкие колебания величины одного или нескольких факторов приводят к постоянному снижению разнообразия в абиотическом блоке. В соответствии с этим разнообразие биосистем, если не на всех, то на каком-то одном из иерархических уровней подсистем будет изменяться альтернативно, т.е. в горных экосистемах по сравнению с предгорными разнообразие в биотическом блоке должно быть меньше, что и имеет место в действительности.
Ранее были рассмотрены некоторые механизмы, изменяющие разнообразие в подсистемах тех или иных уровней иерархии биосистем, способные компенсировать изменения в разнообразии компонентов абиотического блока. Естественно, что перечень таких механизмов гораздо шире, при этом их действие может быть достаточно специфичным в зависимо-
84
ПРИНЦИП АЛЬТЕРНАТИВНОГО РАЗНООБРАЗИЯ
ста от характера изменений абиотических факторов и особенностей биологических систем. Однако даже проведенный краткий анализ, по-видимому, достаточен для разработки некоторых аспектов стратегии хозяйственной деятельности человека в современных условиях, на что хотелось бы вкратце обратить особое внимание.
Как известно, для достижения высокой продуктивности экосистем проводятся различные мероприятия, направленные в конечном счете на упрощение сообществ животных или растений (одновидовые популяции, монокультура, чистые линии и т.п.). При этом сокращаются трофические цепи, снижается разнообразие сообществ и, тем самым, уменьшается рассеивание (диссипация) энергии, расходуемой на обменные процессы. Однако параллельно с уменьшением диссипации энергии снижается устойчивость биосистем (Дре, 1976; Исаченко, 1980; Свирежев, 1984; Киселев, 1986), что требует для поддержания их равновесия со средой вмешательства со стороны человека. Таким образом, человек берет на себя управление устойчивостью биосистем. Последнее вызывает необходимость искусственного повышения разнообразия в блоке абиотических компонентов. Это достигается, например, при культивировании сельскохозяйственных растений путем проведения различных афотехнических мероприятий (внесение удобрений, внедрение некоторых приемов обработки почвы и посевов, борьба с вредителями и болезнями, орошение и т. д.), т. е. совокупностью мер, направленных на увеличение разнообразия комплекса абиотических факторов с целью сохранения динамического равновесия биотического блока экосистемы с внешней средой. При этом, как правило, возрастают энергетические и, соответственно, материальные затраты на поддержание функционирования эксплуатируемых экосистем.
Однако с позиций сформулированного принципа альтернативного разнообразия, по-видимому, гораздо проще и энергетически выгоднее для поддержания динамического равновесия с внешней средой добиваться повышения разнообразия биотических сообществ (будь то посевы сельскохозяйственных растений или популяции охотничье-промысловых видов животных). И хотя это положение уже получило теоретическое обоснование (Межжерин и др., 1981; Свирежев, 1984) и экспериментальное подтверждение (Яблоков, Остроумов, 1983; Боговин, 1990; Мороз, 1990), тем не менее, считаем целесообразным еще раз остановиться на нем.
Каким же может быть выход в практической деятельности человека при эксплуатации биотических сообществ?
Он видится, прежде всего, в кардинальном изменении методологии хозяйствования, заключающемся в том, чтобы при эксплуатации экосис-
85
РАЗНООБРАЗИЕ И ФУНКЦИОНАЛЬНАЯ УСТОЙЧИВОСТЬ ЭКОСИСТЕМ
тем учитывался альтернативный (противоположно направленный) характер взаимодействия структурного разнообразия абиотического и биотического блоков. Так, например, необходим переход от монодоминантных к полидоминантным сообществам, в которых за счет более четкой дифференциации экологических ниш, занимаемых отдельными видовыми популяциями, удается резко повысить эффективность использования ресурсов (Миркин, 1989). Если же это невозможно, то при упрощении эксплуатируемых сообществ растений или животных важно обеспечивать разнообразие хотя бы на низших уровнях иерархии подсистем биотического блока, т.е. должны быть комбинации, в той или иной мере обеспечивающие разнообразие на одном или нескольких уровнях интеграции биосистем. Комбинации типа "монокультура — чистые линии" должны быть, по крайней мере, заменены на комбинации "монокультура — фенотипи-ческое (генетическое) разнообразие" или "поликультура — чистые линии". Реализация таких комбинаций (в зависимости от преследуемых целей) позволит значительно снизить энергетические, а, следовательно, и материальные траты.
Таким образом, современное природопользование должно руководствоваться фундаментальными законами природы, одним из которых является основной кибернетический принцип взаимодействия подсистем в рамках единой системы. Ему соответствует сформулированный нами принцип альтернативного разнообразия, согласно которому функциональная устойчивость экосистем возможна при условии компенсаторного альтернативного изменения разнообразия в структуре их важнейших подсистем (т.е. при разнонаправленности изменений структурного разнообразия в управляющей и управляемой подсистемах). Приведенные кибернетические и биологические закономерности должны играть, несомненно, первостепенную роль при решении современных экологических проблем, а поэтому они имеют огромное значение для выработки стратегии природопользования. Игнорирование этих фундаментальных принципов функционирования экосистем может подорвать естественные основы существования живого и поставить человечество на грань самоуничтожения.
86
