
- •Предисловие
- •1. Дисперсные системы
- •Классификация дисперсных систем
- •Сорбция и сорбционные процессы
- •Коллоидные растворы и коллоиды
- •Устойчивость и коагуляция дисперсных систем
- •Вопросы и задачи
- •2. Комплексные соединения
- •Координационное число Комплексообразователь
- •Пример 2.
- •Вопросы и задачи
- •3. Основы идентификации неорганических Соединений
- •Качественные реакции на ионы. Некоторые ионы легко распознать при помощи следующих качественных реакций:
- •4. Коррозия металлов
- •Вопросы и задачи
- •5. Качество воды
- •Вопросы и задачи
- •6. Химизация сельского хозяйства
- •7. Строительные материалы. Коррозия бетона
- •Вопросы и задачи
- •Варианты индивидуальных заданий
- •Варианты индивидуальных заданий
- •Содержание
5. Качество воды
В естественных условиях вода практически нигде не встречается в химически чистом виде. Природная вода всегда содержит некоторое количество растворенных веществ органического и минерального происхождения. Именно эти примеси в значительной степени определяют качество воды.
Качество воды оценивается рядом показателей, среди которых наиболее важными являются общая минерализация, ионно-солевой состав, жесткость воды, величина рН и т.д.
Под минерализацией воды понимают суммарное содержание в ней всех найденных при химическом анализе минеральных веществ. Это содержание выражают в виде суммы ионов в мг/л или г/л. По величине общей минерализации природные воды делят на следующие группы:
пресные < 1 г/л
в т.ч. очень пресные < 0,1
нормально пресные 0,1 -0,5
пресноватые 0,5 - 1
солоноватые 1-10 г/л
в т.ч. слабосолоноватые 1-3
сильносолоноватые 3-10
соленые 10-50 г/л
рассолы > 50 г/л.
Химический состав воды обычно выражают в виде концентрации ионов, присутствующих в природных водах в значительных количествах:Cl-,SO42-, HCO3-, CO32-, Na+, K+, Ca2+, Mg2+. Наиболее часто результаты ионно-солевого состава выражают в миллиэквивалентах или миллиграммах в 1 литре воды. Иногда для сопоставления содержания отдельных ионов применяют процент - эквивалентную форму. Для этого рассчитывают относительное содержание каждого иона в процентах от суммы всех ионов.
Все природные воды в зависимости от преобладающего аниона делят на гидрокарбонатные и карбонатные (содержат НСО3- и СО32-), сульфатные (SO42-) и хлоридные (Сl-); по преобладающему катиону различают кальциевые, магниевые и натриевые воды. Например, если среди анионов преобладает ион НСО3-, а среди катионов - ион Na+, то такую воду относят к гидрокарбонатным натриевым. В том случае, если кроме преобладающего иона в воде содержится значительное количество другого иона, немного уступающего по содержанию преобладающему, то при характеристике этой воды указывают название и соответствующего иона. При этом название преобладающего иона записывают в конце. Например, если содержание в воде НСО3- - 2,8 мэкв/л, a SO42- - 2,1 мэкв/л, то данная вода относится к сульфатно-гидрокарбонатным.
Под жесткостью воды понимается общее содержание всех растворимых солей кальция и магния. Жесткость выражают суммой миллиэквивалентов ионов Ca2+ и Mg2+, содержащихся в 1 л воды. В зависимости от величины общей жесткости природные воды подразделяют на следующие категории:
< 1,5 мэкв/л – очень мягкие;
1,5-3 мэкв/л – мягкие;
3,0-6,0 мэкв/л – средней жесткости;
6,0-10,0 мэкв/л – жесткие;
> 10 мэкв/л – очень жесткие.
В зависимости от целевого назначения воды ее показатели должны отвечать определенным требованиям. Так, в питьевой воде общая минерализация не должна превышать 1 г/л, величина рН должна находиться в пределах 6,5 - 8,5, а общая жесткость не должна превышать 7 мэкв/л. Поливные воды, применяемые в сельском хозяйстве, не должны содержать солей более 1,5 г/л. Особенно вредно в поливной воде большое содержание ионов Na+, способных вызвать засоление и осолонцевание орошаемых почв.
Для оценки потенциальной опасности осолонцевания почвы при ее орошении минерализованными водами используют п о к а з а т е л ь а д с о р- б и р у е м о с т и н а т р и я или н а т р и е в о е а д с о р б ц и о н н о е о т н о- ш е н и е SAR (sodium adsorption ratio). Величину SAR рассчитывают по формуле:
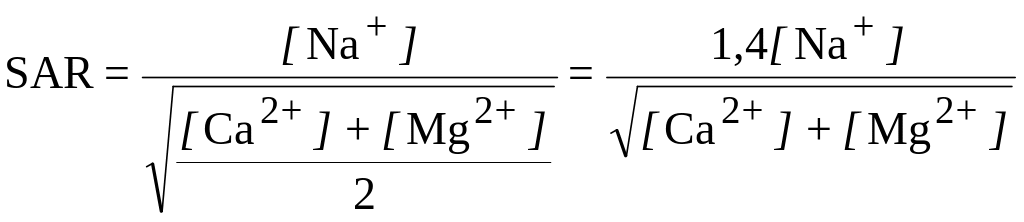 ,
,
где [Na+], [Са2+], [Mg2+] - концентрация ионов в ирригационной воде (в мэкв/л).
Опасность осолонцевания зависит не только oт величины SAR, но и от общей минерализации воды (табл. 2). При величине SAR меньше 8 опасность осолонцевания невелика при всех уровнях минерализации, а при SAR > 16-18 она становится высокой, и использовать такие воды для орошения нецелесообразно.
Таблица 2
Оценка качества воды по опасности засоления и осолонцевания почв
Общая минерализация, г/л |
Опасность засоления почв |
Опасность осолонцевания почв (уровни SAR) |
|||
низкая |
средняя |
высокая |
очень высокая |
||
< 1 |
низкая |
8-10 |
15-18 |
22-26 |
> 26 |
1 - 2 |
средняя |
6-8 |
12-15 |
18-22 |
> 22 |
2 - 3 |
высокая |
4-6 |
9-12 |
14-18 |
> 18 |
> 3 |
очень высокая |
2-4 |
6-9 |
11-14 |
> 14 |
Пример 1.
Рассчитать общую минерализацию воды и содержание ионов в процент-эквивалентной форме, если содержание ионов в воде в мэкв/л составляет: СО32- - 0,13; НСО3- - 2,32; Сl- - 1,36; SO42- - 1,59; Са2+ - 2,16; Mg2+ - 1,36; Na+ - 1,88. Охарактеризовать химический состав воды по преобладающим ионам. Можно ли использовать эту воду в качестве питьевой?
Решение. Вычислим содержание каждого иона в мг/л. Для этого содержание каждого иона, выраженное в мэкв/л, умножим на эквивалентную массу соответствующего иона:
![]() г/моль; 0,13
мэкв/л * 30 г/моль = 3,9 мг/л;
г/моль; 0,13
мэкв/л * 30 г/моль = 3,9 мг/л;
![]() г/моль; 2,32 мэкв/л
* 61 г/моль = 141,5 мг/л;
г/моль; 2,32 мэкв/л
* 61 г/моль = 141,5 мг/л;
![]() г/моль; 1,36
мэкв/л * 35,5 г/моль = 36,9 мг/л;
г/моль; 1,36
мэкв/л * 35,5 г/моль = 36,9 мг/л;
![]() г/моль; 1,59 мэкв/л
* 48 г/моль = 76,3 мг/л;
г/моль; 1,59 мэкв/л
* 48 г/моль = 76,3 мг/л;
![]() г/моль; 2,16 мэкв/л
* 20 г/моль = 43,2 мг/л;
г/моль; 2,16 мэкв/л
* 20 г/моль = 43,2 мг/л;
![]() г/моль; 1,36 мэкв/л
* 12 г/моль = 16,3 мг/л;
г/моль; 1,36 мэкв/л
* 12 г/моль = 16,3 мг/л;
![]() г/моль; 1,88 мэкв/л
* 23 г/моль = 43,2 мг/л.
г/моль; 1,88 мэкв/л
* 23 г/моль = 43,2 мг/л.
∑ ионов = 3,9+141,5 + 36,9 + 76,3 + 43,2 + 16,3 + 43,2 = 361,3 мг/л.
Общая минерализация воды равна 361,3 мг/л. В соответствии с классификацией эта вода относится к нормально пресным.
Рассчитаем содержание каждого нона в процент-эквивалентной форме. Для этого вычислим сумму всех ионов в мэкв/л:
∑ ионов = 0,13 + 2,32+ 1,36+ 1,59 + 2,16+ 1,36+ 1,88 = 10,8 мэкв/л.
Примем сумму ионов за 100 %. Тогда доля каждого иона составит:
![]() %;
%;
![]() %;
%;
![]() %
%
![]() %;
%;
![]() %;
%;
![]() %;
%;
![]() %
%
По
содержанию анионов вода относится к
гидрокарбонатным, поскольку преобладает
ион
![]() ,
количество которого значительно
превышает содержание других анионов;
по катионному составу – к натриево-кальциевым,
т.к. преобладает ион Са2+,
а содержание иона Na+
немного от него отличается.
,
количество которого значительно
превышает содержание других анионов;
по катионному составу – к натриево-кальциевым,
т.к. преобладает ион Са2+,
а содержание иона Na+
немного от него отличается.
Вычислим величину общей жесткости воды:
2,16 + 1,36 = 3,52 мэкв/л,
что соответствует воде средней жесткости.
Поскольку общая минерализация воды не превышает 1 г/л, а общая жесткость воды менее 7 мэкв/л, то данная вода удовлетворяет требованиям, предъявляемым к питьевой воде.
Пример 2.
Рассчитать величину SAR, если содержание катионов в воде (в мэкв/л) составляет: Ca2+ - 6,0; Mg2+ - 8,0; Na+- 17,0, а общая минерализация воды равна 1,9 г/л. Пригодна ли данная вода для орошения?
Решение. Рассчитаем SAR по формуле
![]()
По табл. 2 находим, что при минерализации воды 1,9 г/л опасность засоления почвы при использовании этой воды средняя, а опасность осолонцевания - низкая. Поскольку минерализация воды все же превышает 1,5 г/л, то воду можно считать пригодной для орошения условно.
