
- •Силлабус
- •1. Введение
- •2. Цель дисциплины:
- •3. Задачи дисциплины:
- •Постреквизиты: фармацевтическая химия, технология лекарственных форм, токсикологическая химия.
- •7. Тематический план
- •8. Задания для самостоятельной работы студентов
- •9. Список рекомендуемой литературы
- •10. Методы обучения и преподавания:
- •11. Оценка знаний:
- •Лекционный комплекс Кредит№1
- •Лекция 1. Аналитическая химия и химический анализ. Чувствительность и специфичность реакций. Роль аналитической химии для анализа лекарственных веществ.
- •3. Тезисы лекции:
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 2. Качественный анализ. Классификация катионов и анионов.
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 3. Основные положения теории растворов электролитов, используемых в анализе.
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 4. Применение здм к кислотно-основным равновесиям. Протолитическая теория растворов. Расчет рН и рОн сильных и слабых кислот и оснований.
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 5. Применение здм к гетерогенным равновесиям. Ионное произведение и произведение растворимости.
- •Кредит №2
- •4. Литература:
- •5. Иллюстративный материал:
- •6. Контрольные вопросы:
- •Лекция 3. Методы выделения, разделения и концентрирования
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 6. Количественный анализ. Гравиметрия.
- •Кредит №3
- •Иллюстративный материал:
- •5. Литература:
- •Контрольные вопросы:
- •1. Лекция 3. Окислительно-восстановительное титрование. Требования к реакциям. Индикаторы.
- •Перманганатометрия.
- •Иодиметрия. Иодометрия.
- •Кредит № 4
- •Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 4. Электрохимические методы анализа. Потенциометрия.
- •Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 6. Амперометрическое титрование.
- •Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •Методические рекомендации для занятий по аналитической химии (практические) Практическое занятие №1
- •Практическое занятие №2
- •Практическое занятие №3
- •Практическое занятие №4
- •Практическое занятие №5
- •Кредит №2 Практическое занятие №1
- •Практическое занятие №2
- •Практическое занятие №3
- •Практическое занятие №4
- •Практическое занятие №5
- •Кредит №3 Практическое занятие №1
- •Практическое занятие №2
- •Практическое занятие №3
- •Практическое занятие №4
- •Практическое занятие №5
- •Кредит №4 Практическое занятие №1
- •Практическое занятие №2
- •Практическое занятие №3
- •Практическое занятие №4
- •Практическое занятие №5
- •Срсп №2
- •Срсп №3
- •Срсп №4
- •Срсп №5
- •Срсп №6
- •Срсп №7
- •Срсп №8
- •Кредит №2 срсп №1
- •Срсп №2
- •Срсп №3
- •Срсп №4
- •Срсп №5
- •Срсп №6
- •Срсп №7
- •Срсп №8
- •Кредит №3 срсп №1
- •Срсп №2
- •Срсп №3
- •Срсп №4
- •Срсп №5
- •7. Литература:
- •8. Контроль (вопросы, тесты, задачи и пр.):
- •Срсп №6
- •Срсп №7
- •Срсп №8
- •Кредит №4 срсп №1
- •Срсп №2
- •Срсп №3
- •Срсп №4
- •Срсп №5
- •Срсп №6
- •Срсп №7
- •Срсп №8
- •Методические рекомендации для самостоятельной работы Кредит №1
- •3. Задания:
- •5. Критерии выполнения (требования к выполнению задания):
- •Критерии оценки:
- •Кредит №2
- •Кредит №3
- •Кредит №4
- •Контрольно-измерительные средства для итоговой оценки знаний, умений и навыков
- •Тема 1. Предмет, цели и задачи аналитической химии
- •Тема 2. Качественный анализ.
- •Тема 3. Закон действующих масс. Теории сильных и слабых электролитов
- •Тема 4. Кислотно-основные равновесия
- •Тема 5. Гетерогенные равновесия
- •Тема 6. Окислительно-восстано-вительные равновесия.
- •Тема 7. Равновесия реакций комплексообразования.
- •Тема 8. Теоретические основы использования органических соединений в анализе
- •Тема 11. Подготовка образцов к анализу
- •Тема 12. Количественный анализ. Гравиметрический анализ
- •Тема 13. Титриметрический анализ
- •Тема 14. Кислотно-основное титрование
- •Тема 15 и 16. Окислительно-восстановительное титрование.
- •Тема 17. Осадительное титрование
- •Тема 18. Комплексонометрическое титрование.
- •Тема 19 и 20. Инструментальные методы анализа.
- •Тема 21. Хроматографические методы анализа (гжх, жх, вэжх).
- •2. Ситуационные задачи
- •3. Вопросы зачета, экзамена
- •Содержание
4. Иллюстративный материал:
Таблица 1. Рассчитанные приближенные величины коэффициентов
aктивности f ионов с зарядом z в водных растворах при комнатной
температуре и различных значениях ионной силы раствора Ic
Ic |
f |
|||||
z=l |
z = 2 |
z = 3 |
z = 4 |
z = 5 |
z = 6 |
|
0.05 0.1 0,5 1,0 |
0,84 0,81 0,84 0,99 |
0,50 0,44 0,50 0,96 |
0,21 0,16 0,21 0,91 |
0,062 0,037 0,062 0,85 |
0,013 0,0058 0,013 0,78 |
0,0019 0,00060 0,0020 0.6 9 |
5. Литература:
Основная: 1, 2, 3, 4, 5.
Дополнительная: 7, 8.
6. Контрольные вопросы:
Закон действующих масс.
Теория слабых электролитов. Константа и степень диссоциации.
Основные положения теории сильных электролитов.
Активность ионов, ионная сила раствора, законы Дебая и Хюккеля.
Шкала рН водных растворов электролитов.
Основные типы химических равновесий, применяемых в анализе.
1. Лекция 4. Применение здм к кислотно-основным равновесиям. Протолитическая теория растворов. Расчет рН и рОн сильных и слабых кислот и оснований.
2. Цель лекции: Дать понятие о протолитической теории растворов. Рассмотреть применение ЗДМ к кислотно-основным равновесиям.
3. Тезисы лекции: Согласно протолитической теории кислот и основаниий Бренстеда-Лоури кислота является донором протона, а основание − акцептором протона; кислоты и основания существуют как сопряженные пары; протон Н+ в водном растворе не существует, а образует ион Н3О+. Т.о., кислота − это вещество, выделяющее при ионизации протоны, а основание − вещество, присоединяющее протоны. В рамках этой теории кислотами и основаниями могут быть катионы, анионы или нейтральные молекулы. Вещества − переносчики протонов называют протолитами.
Рассмотрим, следуя протолитической теории Бренстеда-Лоури, процесс обратимого перехода одноосновной кислоты в однокислотное основание в растворе:
![]() (1.1)
(1.1)
Здесь НВ и В- являются соответственно кислотой и основанием, причем они называются сопряженными кислотой и основанием.
Реакциями протолиза называют реакции кислот или оснований с растворителем с участием протонов.
Прототропными называют такие реакции, в которых переносчиками протонов служат не молекулы воды, а частицы других веществ.
Вещества, способные как присоединять, так и отдавать протоны, называются амфолитами. Примерами амфолитов могут служить вода, гидрокарбонат-ион HCO3-.
В самой жидкой воде устанавливается протолитическое равновесие (автопротолиз воды):
![]() или
Н2О
↔ Н+
+ОН- (1.2)
или
Н2О
↔ Н+
+ОН- (1.2)
Процесс диссоциации воды описывается константой химического равновесия
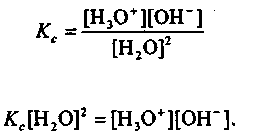 (1.3)
(1.3)
При постоянной температуре константа химического равновесия постоянна: Кс = const. Концентрация воды в чистой воде также постоянна и равна 55,55 моль/л, т. е. [Н2О]2 = const. Произведение Кс[Н2О] = const =Kw. Тогда для автопротолиза воды имеем:
Kw = [Н3О+][ОН-] или Kw = [Н+][ОН-] (1.4)
Величина Kw, называется константа автопротолиза воды или ионное произведение воды. Она постоянна при постоянной температуре. При повышении температуры степень ионизации жидкой воды увеличивается и значение Kw, растет.
В растворах слабых электролитов устанавливается равновесие между ионами и непродиссоциированными молекулами.
Для диссоциации слабой одноосновной кислоты уравнение протолиза имеет вид:
HB + H2O↔B- +H3O+,
тогда истинной термодинамической константой К этого равновесия будет
![]() (1.5)
(1.5)
Так как a (Н2O) = const , тогда
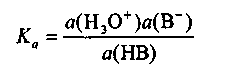 (1.6)
или
(1.6)
или
![]() (1.7)
(1.7)
где все концентрации − равновесные. Здесь величина Ка называется константой кислотной диссоциации или константой кислотности.
Для многих слабых кислот числовые значения Ка очень малы, поэтому вместо величины Ка применяют силовой показатель рКа: рКа = - lg Ka (1.8)
Чем больше Ка (т. е. чем меньше рКа ), тем сильнее кислота.
Аналогично из уравнения протолиза основания в воде выводится константа основности. Для ионизации однокислотного слабого основания В в водных растворах можно записать:
![]()
Если степень ионизации основания α « 1, то за константу данного химического равновесия можно принять концентрационную константу
![]()
![]()
![]() (1.9)
(1.9)
Величина Кb называется константой диссоциации слабого однокислотного основания или просто константой основности этого основания, а величина
![]() (1.10)
(1.10)
силовым показателем константы основности.
Для воды: pKw = pKa + pKb
