
- •Силлабус
- •1. Введение
- •2. Цель дисциплины:
- •3. Задачи дисциплины:
- •Постреквизиты: фармацевтическая химия, технология лекарственных форм, токсикологическая химия.
- •7. Тематический план
- •8. Задания для самостоятельной работы студентов
- •9. Список рекомендуемой литературы
- •10. Методы обучения и преподавания:
- •11. Оценка знаний:
- •Лекционный комплекс Кредит№1
- •Лекция 1. Аналитическая химия и химический анализ. Чувствительность и специфичность реакций. Роль аналитической химии для анализа лекарственных веществ.
- •3. Тезисы лекции:
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 2. Качественный анализ. Классификация катионов и анионов.
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 3. Основные положения теории растворов электролитов, используемых в анализе.
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 4. Применение здм к кислотно-основным равновесиям. Протолитическая теория растворов. Расчет рН и рОн сильных и слабых кислот и оснований.
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 5. Применение здм к гетерогенным равновесиям. Ионное произведение и произведение растворимости.
- •Кредит №2
- •4. Литература:
- •5. Иллюстративный материал:
- •6. Контрольные вопросы:
- •Лекция 3. Методы выделения, разделения и концентрирования
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 6. Количественный анализ. Гравиметрия.
- •Кредит №3
- •Иллюстративный материал:
- •5. Литература:
- •Контрольные вопросы:
- •1. Лекция 3. Окислительно-восстановительное титрование. Требования к реакциям. Индикаторы.
- •Перманганатометрия.
- •Иодиметрия. Иодометрия.
- •Кредит № 4
- •Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 4. Электрохимические методы анализа. Потенциометрия.
- •Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 6. Амперометрическое титрование.
- •Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •Методические рекомендации для занятий по аналитической химии (практические) Практическое занятие №1
- •Практическое занятие №2
- •Практическое занятие №3
- •Практическое занятие №4
- •Практическое занятие №5
- •Кредит №2 Практическое занятие №1
- •Практическое занятие №2
- •Практическое занятие №3
- •Практическое занятие №4
- •Практическое занятие №5
- •Кредит №3 Практическое занятие №1
- •Практическое занятие №2
- •Практическое занятие №3
- •Практическое занятие №4
- •Практическое занятие №5
- •Кредит №4 Практическое занятие №1
- •Практическое занятие №2
- •Практическое занятие №3
- •Практическое занятие №4
- •Практическое занятие №5
- •Срсп №2
- •Срсп №3
- •Срсп №4
- •Срсп №5
- •Срсп №6
- •Срсп №7
- •Срсп №8
- •Кредит №2 срсп №1
- •Срсп №2
- •Срсп №3
- •Срсп №4
- •Срсп №5
- •Срсп №6
- •Срсп №7
- •Срсп №8
- •Кредит №3 срсп №1
- •Срсп №2
- •Срсп №3
- •Срсп №4
- •Срсп №5
- •7. Литература:
- •8. Контроль (вопросы, тесты, задачи и пр.):
- •Срсп №6
- •Срсп №7
- •Срсп №8
- •Кредит №4 срсп №1
- •Срсп №2
- •Срсп №3
- •Срсп №4
- •Срсп №5
- •Срсп №6
- •Срсп №7
- •Срсп №8
- •Методические рекомендации для самостоятельной работы Кредит №1
- •3. Задания:
- •5. Критерии выполнения (требования к выполнению задания):
- •Критерии оценки:
- •Кредит №2
- •Кредит №3
- •Кредит №4
- •Контрольно-измерительные средства для итоговой оценки знаний, умений и навыков
- •Тема 1. Предмет, цели и задачи аналитической химии
- •Тема 2. Качественный анализ.
- •Тема 3. Закон действующих масс. Теории сильных и слабых электролитов
- •Тема 4. Кислотно-основные равновесия
- •Тема 5. Гетерогенные равновесия
- •Тема 6. Окислительно-восстано-вительные равновесия.
- •Тема 7. Равновесия реакций комплексообразования.
- •Тема 8. Теоретические основы использования органических соединений в анализе
- •Тема 11. Подготовка образцов к анализу
- •Тема 12. Количественный анализ. Гравиметрический анализ
- •Тема 13. Титриметрический анализ
- •Тема 14. Кислотно-основное титрование
- •Тема 15 и 16. Окислительно-восстановительное титрование.
- •Тема 17. Осадительное титрование
- •Тема 18. Комплексонометрическое титрование.
- •Тема 19 и 20. Инструментальные методы анализа.
- •Тема 21. Хроматографические методы анализа (гжх, жх, вэжх).
- •2. Ситуационные задачи
- •3. Вопросы зачета, экзамена
- •Содержание
Кредит № 4
1. Лекция 1. Инструментальные методы анализа. Классификация ИМА.
2. Цель лекции: Дать понятие об инструментальных методах анализа. Рассмотреть понятия правильности и воспроизводимости ИМА.
3. Тезисы лекции: Физические и физико-химические методы анализа основаны на использовании зависимости между измеряемыми физическими свойствами веществ и их качественным и количественным составом. Эти методы анализа называют также инструментальными методами.
Классификация физических и физико-химических методов анализа основана на учете измеряемых физических и физико-химических свойств вещества или изучаемой системы.
Оптические методы основаны на измерении оптических свойств веществ.
Хроматографические методы основаны на использовании способности различных веществ к избирательной сорбции.
Электрохимические методы основаны на измерении электрохимических свойств систем.
Радиометрические методы основаны на измерении радиоактивных свойств веществ.
Термические методы основаны на измерении тепловых эффектов соответствующих процессов.
Масс-спектрометрические методы основаны на изучении ионизированных фрагментов («осколков») веществ.
Применяются также и другие методы анализа (ультразвуковые, магнитохимические, пикнометрические и др.).
Чувствительность метода определяется двумя факторами: интенсивностью измеряемого физического свойства и чувствительностью детекторов сигнала в приборе для инструментального анализа.
Фотометрические методы обладают чувствительностью от 10-6 г, а радиометрические − до 1· 10-15 г. Высокая чvвствительность многих методов объясняется свойствами применяемых детекторов сигнала в приборах. Электрохимические методы имеют высокую чувствительность благодаря применению высокочувствительных регистраторов тока и потенциала.
Важным преимуществом многих инструментальных методов является их высокая избирательность − селективность. Ряд инструментальных методов, (рефрактометрия, интерферометрия) - неселективны и используются в тех случаях, когда анализируются либо индивидуальные вещества, либо несложные смеси. Высокая степень селективности присуща методам, основанным на характерных свойствах молекул, функциональных группировок, атомов, обладающих эмиссионными и абсорбционными спектрами, радиоактивностью, способностью к электрохимическому восстановлению или окислению
Правильность инструментальных методов анализа зависит от того, насколько свойство адекватно отражает состав и связано с ним строго определенными закономерностями. Закономерности, связывающие свойство и состав, устанавливают экспериментально. Поэтому при проведении инструментального анализа предварительно проводят калибровку аналитических приборов и выявление зависимости физического свойства от состава. Эти задачи решаются с помощью стандартных образцов.
Для получения точных результатов на приборе производят обычно не менее 3-5 измерений образца, затем их обрабатывают методами математической статистики. Точность инструментальных методов сильно колеблется в зависимости от метода (от 0,001 % до 0,1 %).
В инструментальном анализе применяют несколько методов определения концентраций веществ. В общем виде их можно разделить на две группы использованием стандартов веществ и с применением аналитических факторов (показателей) веществ. Стандарты используют в следующих методах аналитических определений.
Метод калибровочного графика. Готовят серию разведений стандартного раствора вещества с известной концентрацией, замеряют на приборе характеристику свойства приготовленных растворов. По полученным данным строят калибровочный график. Затем измеряют характеристику анализируемого раствора и по графику определяют его концентрацию.
Метод сравнения (метод стандарта). Используется в тех случаях, когда линия зависимости состав − свойство имеет прямолинейный характер и проходит через начало осей координат. На приборе замеряют характеристики свойств стандартного и анализируемого растворов. При этом отношение концентраций стандартного и анализируемого растворов равно отношению характеристик:
Сс /Сх =fc/fx (1.1)
Метод сравнения обладает меньшей точностью, чем метод калибровочного графика (используется только одно измерение стандарта).
Метод добавок. Замеряют сначала свойство анализируемого paствopa, затем повторяют измерение, добавив к раствору определенное количество стандарта. Если зависимость состав свойство прямолинейна, то приращение концентрации анализируемого раствора Сс вызывает соответствующее приращение характеристики свойств fc и можно записать равенства:
(Сх + Сс) / Сс = (fx + fc) / fc (1.2)
Откуда Сх = Сс fx / fc (1.3)
Метод аналитических факторов (показателей). Этот метод основан на использовании численных значений свойства, отвечающих единице концентрации вещества. Аналитические факторы употребляют в расчетах при строгом соблюдении определенных закономерностей, связывающих характеристику свойства вещества с его концентрацией в растворе. Применяют два вида аналитических факторов: молярные показатели Fм - соответствующие молярной концентрации вещества (моль/дм3); удельные показатели F% - соответствующие процентной концентрации вещества. Расчет концентраций при использовании аналитических факторов значительно упрощается. Измеряют свойство раствора и делят его на фактор. При этом получают концентрацию вещества в растворе в соответствующих единицах:
С = f / F (моль/дм3); С = а / F (в %). (1.4)
Кривые инструментального титрования строят в координатах: свойство титруемого раствора − объем добавленного титранта. В точке эквивалентности на кривой титрования наблюдается перелом. В общем случае различают интегральные кривые − на графике откладывается значение свойства и дифференциальные − на графике откладывается разностное значение свойства (разность между двумя последовательными измерениями свойства).
4. Иллюстративный материал:
Табл.1

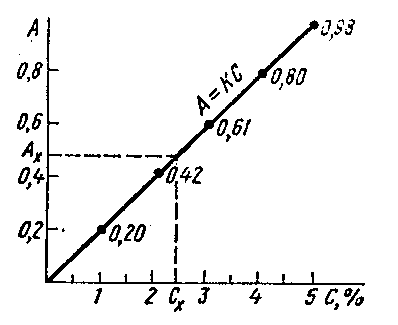 Рис.1.
Калибровочный график фотометрического
определения
Рис.1.
Калибровочный график фотометрического
определения
5. Литература:
Основная: 1, 2, 3, 4, 5.
Дополнительная: 7, 8.
6. Контрольные вопросы:
Понятие об инструментальных методах анализа.
Классификация ИМА.
Чувствительность, воспроизводимость и правильность ИМА.
Основные блоки аналитических приборов.
Методы проведения количественных измерений в ИМА.
1. Лекция 2. Оптические методы анализа. Закон Бугера-Ламберта-Бера.
2. Цель лекции: Изучить оптические методы анализа и их классификацию. Рассмотреть методы атомно-абсорбционного анализа (фотоколориметрия, спектрофотометрия).
3. Тезисы лекции: Оптические методы анализа основаны на измерении оптических свойств вещества, проявляющихся при взаимодействии электромагнитного излучения с веществом.
Оптические методы анализа классифицируют:
а) По изучаемым объектам на атомный и молекулярный спектральный анализы.
б) По характеру взаимодействия электромагнитного излучения с веществом. Различают следующие методы.
Атомно-абсорбционный анализ основан на измерении поглощения монохроматического излучения атомами определяемого вещества в газовой фазе после атомизации вещества.
Эмиссионный спектральный анализ основан на измерение интенсивности света, излучаемого веществом при его энергетическом возбуждении.
Пламенная фотометрия основана на использовании газового пламени в качестве источника энергетического возбуждения излучения.
Молекулярный абсорбционный анализ. В основе метода лежит измерение светопоглощения молекулами или ионами изучаемого вещества. Наиболее распространен.
Люминесцентный анализ основан на измерение интенсивности излучения люминесценции, т.е. испускания излучения веществом под воздействием различных видов возбуждения.
Спектральный анализ с использованием эффекта комбинационного рассеяния света (раман-эффекта) основан на измерении интенсивности излучения при явлении комбинационного рассеяния света.
Нефелометрический анализ основан на измерении рассеивания света частицами света дисперсной системы.
Турбидиметрический анализ основан на измерении ослабления интенсивности излучения при его прохождении через дисперсную среду.
Рефрактометрический анализ основан на измерении показателей светопреломления веществ.
Интерферометрический анализ основан на изучении явления интерференции света.
Поляриметрический анализ основан на измерении величины угла вращения плоскости поляризации света оптически активными веществами.
Оптический диапазон подразделяют на ультрафиолетовую − УФ (100-380 нм),
видимую − В (380-760 нм) и инфракрасную − ИК (760-105 нм) область спектра.
В основе фотометрических измерений и расчетов лежит закон светопоглощения, характеризующий зависимость поглощения монохроматического излучения от толщины поглощающего слоя и от концентрации светопоглощающих частиц. Основной закон светопоглощения или закон Бугера-Ламберта-Бера гласит: интенсивность поглощения света растворами вещества пропорциональна их концентрации С и толщине поглощающего слоя l. Закон можно представить в экспоненциальной форме:
![]() (1.1)
(1.1)
или в логарифмической форме:
![]() (1.2)
(1.2)
Основной закон светопоглощения справедлив только для поглощения монохроматического светового потока с постоянной длиной волны λ = const.
В количественном анализе обычно используется логарифмическая форма (1.2) основного закона светопоглощения, поскольку оптическая плотность А прямо пропорциональна концентрации с.
Величину ε называют молярным коэффициентом (показателем) по- гашения, или молярным коэффициентом (показателем) экстинкции. Кроме оптической плотности А используют также пропускание, или светопропускание:
![]() (1.3)
(1.3)
которое связано с оптической плотностью А следующим образом:
![]() (1.4)
(1.4)
A = 2- lg T (1.5)
Рабочий интервал изменения оптической плотности, приемлемый для аналитических фотометрических измерений, составляет 0,2-0,8 единиц, оптимальный − 0,2-0,6 единиц; наименьшую ошибку получают при значении оптической плотности 0,434.
Фотоколориметрия. Метод основан на измерении интенсивности немонохроматического светового потока, прошедшего через анализируемый раствор, с помощью фотоэлементов в фотоколориметрах и в фото-электроколориметрах. Световой поток от источника излучения (лампы накаливания) проходит через светофильтр, пропускающий излучение лишь в определенном интервале длин волн, затем через кювету с анализируемым раствором и попадает на фотоэлемент, преобразующий световую энергию в фототок, регистрируемый соответствующим прибором. Чем больше светопоглощение анализируемого раствора (т.е. чем выше его оптическая плотность), тем меньше энергия светового потока, попадающего на фотоэлемент.
Разработаны различные конструкции фотоэлектроколориметров, предназначенных для работы в ближней УФ и в видимой области спектра. Светофильтры, чаще всего это стекла различного состава и окраски, пропускают излучение шириной в несколько десятков нм (≈ от 20 до 50 нм).
Наиболее распространенными являются фотоэлектроколориметры с одним или с двумя фотоэлементами. Фотоэлектроколориметры с одним фотоэлементом предусматривают измерение энергии однолучевого светового потока. Приборы с двумя фотоэлементами измеряют энергию двух световых потоков, один из которых проходит через анализируемый раствор, а другой − через раствор сравнения («нулевой» раствор).
Концентрацию определяемого вещества в анализируемом растворе находят либо с использованием основного закона светопоглощения, либо методом градуировочного графика. Относительная ошибка фото-колориметрического определения концентрации обычно не превышает ± 3%.
Метод обладает сравнительно высокой чувствительностью и хорошей воспроизводимостью, селективностью, прост по выполнению измерений оптической плотности или пропускания, использует относительно несложную аппаратуру. Однако немонохроматичность регистрируемого светового потока несколько понижает точность и воспроизводимость аналитических измерений.
Спектрофотометрия. Этот метод основан на использовании спектрофотометров, позволяющих регистрировать световые потоки в широком интервале изменения длин волн (от 185 нм до 1100 нм) и обеспечивающих высокую степень монохроматичности света (0,2-5 нм), проходящего через анализируемую среду. В большинстве спектрофотометров монохроматизация светового потока осуществляется за счет использования диспергирующих элементов − призм или дифракционных решеток. В качестве источника излучения в спектрофотометрах используют лампы накаливания и водородные либо дейтериевые лампы.
Разработаны различные приемы спектрофотометрии − прямая, дифференциальная, производная спектрофотометрия, спектрофотометрическое титрование.
Концентрацию определяемого вещества в анализируемом растворе при спектрофотометрических измерениях находят с использованием либо основного закона светопоглощения, либо градуировочных графиков.
Спектрофотометрические методы обладают, по сравнению с фото-электроколориметрическими, большей точностью и чувствительностью, позволяют проводить анализ многокомпонентных систем без разделения компонентов, определять вещества, не поглощающие в видимой области спектра (но имеющие полосы поглощения в УФ диапазоне). Относительные ошибки спектрофотометрических определений не превышают ±2%.
В отличие от фотоколориметрии и фотоэлектроколориметрии, спектрофотометрия позволяет получать спектры поглощения в широком спектральном диапазоне.
Иллюстративный материал:
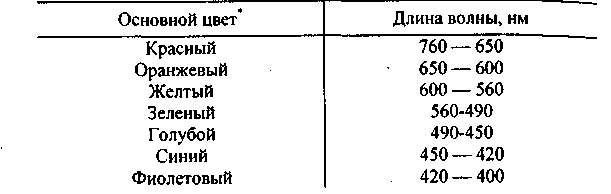 Табл.1 Основные
цвета видимого спектра
Табл.1 Основные
цвета видимого спектра
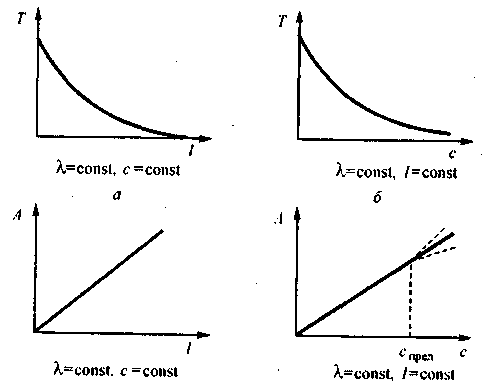
Рис.1. Зависимости пропускания и оптической плотности от толщины поглощающего слоя l и концентрации раствора С.
5. Литература:
Основная: 1, 2, 3, 4, 5.
Дополнительная: 7, 8.
6. Контрольные вопросы:
Оптические методы анализа. Классификация и сущность методов.
Атомно-абсорбционный анализ.
Фотоколориметрия. Основной закон светопоглощения.
Спектрофотометрия.
Примеры практического применения методов.
1. Лекция 3. Хроматографические методы анализа.
2. Цель лекции: Изучить инструментальные хроматографические методы анализа. Рассмотреть методы ЖХ и ГЖХ.
3. Тезисы лекции: Газовая хроматография − процесс разделения компонентов смеси, основанный на различии в равновесном распределении компонентов между двумя фазами − газом-носителем и либо твердой фазой, либо жидкостью, нанесенной в виде тонкой пленки на поверхность твердого носителя или стенки хроматографической колонки. В первом случае метод называется газоадсорбционной хроматографией, во втором − газожидкостной (распределительной) хроматографией. Наиболее распространенной является распределительная газожидкостная хроматография − ГЖХ.
Сущность метода ГЖХ состоит в следующем. Анализируемая смесь летучих компонентов переводится в парообразное состояние и смешивается с потоком инертного газа-носителя, образуя с ним подвижную фазу. Эта смесь попадает в хроматографическую колонку, заполненную неподвижной (стационарной) жидкой фазой.
Поскольку сродство различных разделяемых веществ к НФ различно, то в процессе сорбционных − десорбционных переходов они задерживаются в НФ неодинаковое время. Пары разделенных компонентов вместе с газом-носителем поступают в детектор хроматографа, генерирующий электрический сигнал. Электрический сигнал усиливается и фиксируется регистратором хроматографа в виде хроматограммы, записываемой на диаграммной ленте или на мониторе компьютера. Эти хроматограммы и используются для качественной и количественной обработки результатов анализа разделяемой смеси компонентов
Хроматограмма − это зарегистрированная во времени последовательность показаний регистратора. Каждому разделенному компоненту смеси соответствует свой пик на хроматограмме. По оси абсцисс откладывается время (или расстояние), по оси ординат − величина аналитического сигнала.
Время удерживания − качественная характеристика каждого компонента; измеряется от момента ввода пробы до момента выхода максимума (вершины) пика. Оно зависит от природы хроматографируемого вещества и газа-носителя, скорости прохождения ПФ через хроматографическую колонку, от природы и массы НФ, температуры, длины колонки. Чем выше коэффициент распределения хроматографируемого вещества, тем больше и его время удерживания.
Хроматографирование проводят на газовых (газожидкостных) хроматографах различной конструкции. На рис.1показана принципиальная блок-схема газового хроматографа.
Идентификация разделяемых компонентов проводится преимущественно двумя методами: с использованием веществ-свидетелей и времени удерживания.
Для расчета содержания определяемых компонентов в хроматографируемых смесях применяют следующие методы: абсолютной градуировки (калибровки), внутренней нормализации и внутреннего стандарта. Все методы основаны на измерении параметров пиков на хроматограмме: их площади или высоты. Чаще измеряют площади пиков. Использование площадей пиков при количественном определении содержания компонентов смеси основано на существовании прямой пропорциональной зависимости между площадью пика данного компонента смеси и его содержанием в хроматографируемой пробе:
![]() (1.1)
(1.1)
где S- площадь пика на хроматограмме, т - масса данного компонента в пробе, к - коэффициент пропорциональности.
Площади пиков на хроматограмме измеряют интегратором хроматографа. Это − наиболее точный метод; ошибка измерения площади пика − меньше 1%. При отсутствии интегратора площадь пиков рассчитывают, измеряя их высоту и ширину или полуширину. В этом случае погрешности определения площади пиков достигают нескольких процентов.
Методы ГЖХ используются для разделения различных смесей, в том числе оптических изомеров, идентификации веществ, их количественного определения. В фармакопейном анализе ГЖХ используют при контроле качества субстанций и лекарственных форм, чаще всего для идентификации и определения остаточных летучих растворителей, следы которых сохраняются в препаратах при их получении. Методами высокоэффективной капиллярной ГЖХ определяют метаболические профили биологических сред − крови, мочи, слюны.
Высокоэффективная жидкостная хроматография (ВЭЖХ), или жидкостная хроматография высокого давления, основана на тех же принципах, что и ГЖХ, только вместо газа-носителя в качестве ПФ применяется поток жидкости, не смешивающейся с жидкой НФ хроматографической колонки. Разделение компонентов основано на различии их коэффициентов распределения между НФ и ПФ.
ВЭЖХ очень широко применяется для идентификации, разделения и определения самых различных веществ: оптически активных соединений белков, нуклеиновых и аминокислот, полисахаридов, красителей, взрывчатых веществ, биологических сред, лекарственных препаратов и т.д.
При технологическом и фармакопейном контроле качества лекарственных субстанций и лекарственных форм ВЭЖХ стала одним из основных методов определения как самих фармакологически активных веществ, так и вспомогательных компонентов и посторонних примесей. Так, например, методом ВЭЖХ анализируют лекарственные препараты амизол, вальпроат натрия, глиборал, диклофенак натрия, козаар, кофеин, лидокаина гидрохлорид, парацетамол, пилокарпина гидрохлорид, пирацетам, соталола и цетилпиридина гидрохлориды, флуконазол и др.
