
- •Силлабус
- •1. Введение
- •2. Цель дисциплины:
- •3. Задачи дисциплины:
- •Постреквизиты: фармацевтическая химия, технология лекарственных форм, токсикологическая химия.
- •7. Тематический план
- •8. Задания для самостоятельной работы студентов
- •9. Список рекомендуемой литературы
- •10. Методы обучения и преподавания:
- •11. Оценка знаний:
- •Лекционный комплекс Кредит№1
- •Лекция 1. Аналитическая химия и химический анализ. Чувствительность и специфичность реакций. Роль аналитической химии для анализа лекарственных веществ.
- •3. Тезисы лекции:
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 2. Качественный анализ. Классификация катионов и анионов.
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 3. Основные положения теории растворов электролитов, используемых в анализе.
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 4. Применение здм к кислотно-основным равновесиям. Протолитическая теория растворов. Расчет рН и рОн сильных и слабых кислот и оснований.
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 5. Применение здм к гетерогенным равновесиям. Ионное произведение и произведение растворимости.
- •Кредит №2
- •4. Литература:
- •5. Иллюстративный материал:
- •6. Контрольные вопросы:
- •Лекция 3. Методы выделения, разделения и концентрирования
- •4. Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 6. Количественный анализ. Гравиметрия.
- •Кредит №3
- •Иллюстративный материал:
- •5. Литература:
- •Контрольные вопросы:
- •1. Лекция 3. Окислительно-восстановительное титрование. Требования к реакциям. Индикаторы.
- •Перманганатометрия.
- •Иодиметрия. Иодометрия.
- •Кредит № 4
- •Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 4. Электрохимические методы анализа. Потенциометрия.
- •Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •1. Лекция 6. Амперометрическое титрование.
- •Иллюстративный материал:
- •5. Литература:
- •6. Контрольные вопросы:
- •Методические рекомендации для занятий по аналитической химии (практические) Практическое занятие №1
- •Практическое занятие №2
- •Практическое занятие №3
- •Практическое занятие №4
- •Практическое занятие №5
- •Кредит №2 Практическое занятие №1
- •Практическое занятие №2
- •Практическое занятие №3
- •Практическое занятие №4
- •Практическое занятие №5
- •Кредит №3 Практическое занятие №1
- •Практическое занятие №2
- •Практическое занятие №3
- •Практическое занятие №4
- •Практическое занятие №5
- •Кредит №4 Практическое занятие №1
- •Практическое занятие №2
- •Практическое занятие №3
- •Практическое занятие №4
- •Практическое занятие №5
- •Срсп №2
- •Срсп №3
- •Срсп №4
- •Срсп №5
- •Срсп №6
- •Срсп №7
- •Срсп №8
- •Кредит №2 срсп №1
- •Срсп №2
- •Срсп №3
- •Срсп №4
- •Срсп №5
- •Срсп №6
- •Срсп №7
- •Срсп №8
- •Кредит №3 срсп №1
- •Срсп №2
- •Срсп №3
- •Срсп №4
- •Срсп №5
- •7. Литература:
- •8. Контроль (вопросы, тесты, задачи и пр.):
- •Срсп №6
- •Срсп №7
- •Срсп №8
- •Кредит №4 срсп №1
- •Срсп №2
- •Срсп №3
- •Срсп №4
- •Срсп №5
- •Срсп №6
- •Срсп №7
- •Срсп №8
- •Методические рекомендации для самостоятельной работы Кредит №1
- •3. Задания:
- •5. Критерии выполнения (требования к выполнению задания):
- •Критерии оценки:
- •Кредит №2
- •Кредит №3
- •Кредит №4
- •Контрольно-измерительные средства для итоговой оценки знаний, умений и навыков
- •Тема 1. Предмет, цели и задачи аналитической химии
- •Тема 2. Качественный анализ.
- •Тема 3. Закон действующих масс. Теории сильных и слабых электролитов
- •Тема 4. Кислотно-основные равновесия
- •Тема 5. Гетерогенные равновесия
- •Тема 6. Окислительно-восстано-вительные равновесия.
- •Тема 7. Равновесия реакций комплексообразования.
- •Тема 8. Теоретические основы использования органических соединений в анализе
- •Тема 11. Подготовка образцов к анализу
- •Тема 12. Количественный анализ. Гравиметрический анализ
- •Тема 13. Титриметрический анализ
- •Тема 14. Кислотно-основное титрование
- •Тема 15 и 16. Окислительно-восстановительное титрование.
- •Тема 17. Осадительное титрование
- •Тема 18. Комплексонометрическое титрование.
- •Тема 19 и 20. Инструментальные методы анализа.
- •Тема 21. Хроматографические методы анализа (гжх, жх, вэжх).
- •2. Ситуационные задачи
- •3. Вопросы зачета, экзамена
- •Содержание
4. Литература:
Основная: 1, 2, 3, 4, 5.
Дополнительная: 7, 8.
5. Иллюстративный материал:
Таблица 7.3. Константы устойчивости (lg β) хелатов меди(П)
с 5- и 6-членными металлоциклами с однотипными
координационными связями
Реакция |
Металлоциклы |
lgβ |
Cu2++En=[CuEn]2+ |
Пятичленные |
10,72 |
Cu2++2En = [CuEn2]2+ |
|
20,03 |
Cu2++tn = [Cutn]2+ |
Шестичленные |
9,98 |
Cu2++2tn = [Cutn2]2+ |
|
17,17 |
Лиганд Еn — этилендиамин NH2CH2CH2NH2-
Лиганд tn — триметилендиамин NH2CH2CH2CH2NH2
6. Контрольные вопросы:
Внутрикомплексные соединения. Хелаты.
ФАГ. ААГ. Правило Чугаева.
Важнейшие органические реагенты, применяемые в анализе.
Области использования органических соединений в анализе.
Лекция 3. Методы выделения, разделения и концентрирования
веществ в аналитической химии.
2. Цель лекции: Дать понятие о методах разделения и концентрирования веществ.
3. Тезисы лекции: При проведении химического анализа часто приходится решать задачи по открытию или определению данного вещества либо в присутствии других веществ, либо тогда, когда концентрация определяемого вещества очень мала, либо в таких случаях, когда и концентрация определяемого вещества незначительна и имеются примеси мешающих веществ. В подобных ситуациях необходимо осуществлять разделение или концентрирование веществ.
Разделение − это операция (процесс), в результате которой компоненты, составляющие исходную смесь, отделяются друг от друга. При этом концентрации разделяемых компонентов могут быть одинаковыми или различными.
Концентрирование − это такая операция (процесс), в результате которой повышается отношение концентрации (количества) микрокомпонента к концентрации (количеству) макрокомпонента (или основы).
Под микрокомпонентом и макрокомпонентом подразумевают составные компоненты смеси, находящиеся соответственно в микроколичестве и в макроколичестве.
Различают абсолютное концентрирование и относительное концентрирование.
Абсолютное концентрирование − это перевод микрокомпонента из большой массы (или большого объема) образца в малую массу (или в малый объем).
При этом повышается концентрация микрокомпонента.
Относительное концентрирование (обогащение) − это увеличение отношения между количествами микрокомпонента и макрокомпонента. К макрокомпонентам в этом случае относится и растворитель. Относительное концентрирование можно рассматривать как частный случай разделения, в результате которого концентрации компонентов смеси оказываются резко различными.
Результаты концентрирования количественно характеризуют коэффициентом (фактором) концентрирования F :
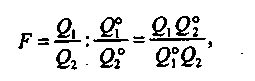 (9.1)
(9.1)
где Q°1 и Q°2 − соответственно количество (или концентрация) микрокомпонента и макрокомпонента до концентрирования; Q1 и Q2 − соответственно количество (или концентрация) микрокомпонента и макрокомпонента после концентрирования. В случае абсолютного концентрирования Q°1 и Q°2 − объем раствора до и после концентрирования.
Методы разделения и концентрирования основаны на использовании различий в свойствах компонентов анализируемой системы, таких, как растворимость, температура кипения, скорость движения частиц во внешнем электрическом поле, сорбция и др. К числу наиболее распространенных методов разделения и концентрирования относятся следующие.
Методы испарения (упаривание, перегонка, сублимация) основы, в которой содержится концентрируемый компонент. Обычно различает упаривание и выпаривание. Упаривание − испарение основы, при котором часть ее остается в системе по окончании процесса испарения. Выпаривание (досуха) − испарение основы, при котором последняя удаляется полностью.
Озоление − метод, при котором исходный анализируемый материал путем термической обработки на воздухе превращают в минеральный остаток − золу. Применяют тогда, когда определяемый компонент (например, металлы-микроэлементы) распределен в большой массе сгораемой основы. Метод часто используют при анализе растительного лекарственного сырья − осторожно сжигают на воздухе сухую массу сырья.
Кристаллизация − метод, применяемый для концентрирования примесных веществ (например, так называемый метод зонной плавки).
Экстракция − совокупность методов, основанных на использовании различий в растворимости извлекаемого компонента в двух контактирующих несмешивающихся фазах (двух жидких или жидкой и твердой). Экстракция относится к наиболее эффективным методам разделения веществ. Экстракционные методы используют при извлечении различных компонентов из растительного и минерального сырья, для выделения газов из металлов и сплавов при высоких температурах, для отделения одних компонентов раствора от других и т. д. Процесс экстракции количественно описывается константой распределения, коэффициентом распределения, степенью извлечения и константой экстракции. На процессы экстракции оказывают влияние: объем экстрагента, число экстракций, рН среды, наличие посторонних примесей.
Сорбционные методы − основаны на использовании различий в способности разделяемых или концентрируемых компонентов поглощаться веществами-носителями. Используют адсорбцию (поглощение поверхностью), абсорбцию (поглощение в объеме), хемосорбцию (поглощение, сопровождаемое протеканием химических реакций). Во многих случаях все эти виды сорбции наблюдаются одновременно.
При концентрировании микроколичеств веществ из сорбционных методов часто применяют избирательную адсорбцию. В качестве сорбента используют твердые фазы с высокоразвитой поверхностью − активированный уголь, кремнезем (силикагель), оксиды и гидроксиды металлов, их соли, синтетические полимерные вещества и др.
Электрохимические методы. Для разделения и идентификации компонентов смесей применяют методы электрофореза, основанные на использовании различий в скоростях движения заряженных частиц растворенных веществ во внешнем электрическом поле. Перемещаясь с различными скоростями под действием внешнего электрического поля, заряженные частицы (ионы) в конце концов разделяются на зоны, каждая из которых содержит ионы одинаковой природы. Эти зоны можно затем идентифицировать различными способами.
Электрофорез проводят либо в свободной незакрепленной среде (в вободной жидкости) − фронтальный электрофорез, либо в закрепленной среде − зональный электрофорез − на крупнопористых носителях (фильтровальная бумага, целлюлоза, порошкообразная пластмасса, агар-агар, ацетилцеллюлоза, стеклянный порошок) или на мелкопористых носителях (силикагель, полиакриламидный гель, целлюлоза, оксид алюминия, крахмал и др.).
Хроматографические методы − совокупность различных методов, основанных на различии в сродстве разделяемых компонентов, перемещающихся с подвижной фазой (жидкость, газ), к неподвижной фазе (твердое вещество, вязкая жидкость).
4. Иллюстративный материал:
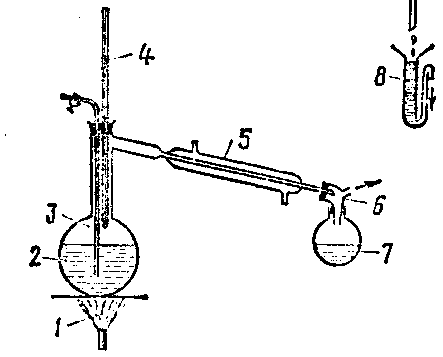
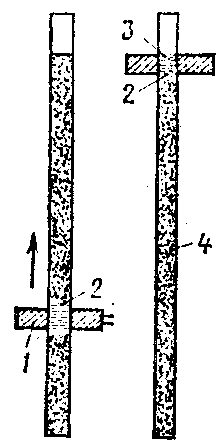
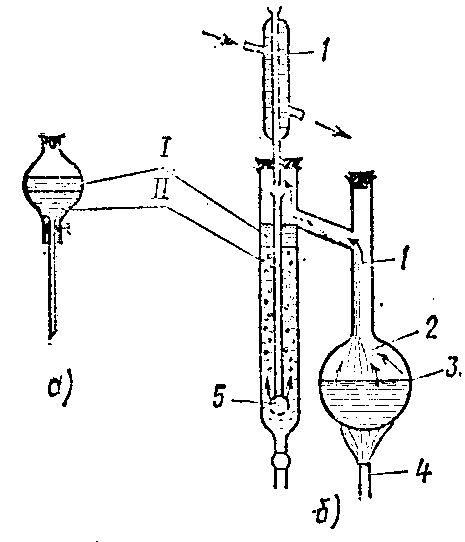
Рис.1. Аппарат для Рис.2. Очистка веществ рис.3. Прибор для
аналитической перегонки методом зонной плавки жидкостной экстракции
5. Литература:
Основная: 1, 2, 3, 4, 5.
Дополнительная: 7, 8.
6. Контрольные вопросы:
Методы выделения и разделения веществ
Методы концентрирования веществ. Абсолютное и относительное концентрирование.
Методы испарения.
Метод озоления.
Кристаллизация.
Экстракция. Сорбционные методы.
Электрохимические методы.
1. Лекция 4. Хроматографические методы анализа
2. Цель лекции: Дать понятие о хроматографии. Рассмотреть классификацию хроматографических методов анализа и их теоретические основы.
3. Тезисы лекции: Хроматография − область науки, изучающая процессы, основанные на перемещении зоны вещества вдоль слоя сорбента в потоке подвижной фазы и связанные с многократным повторением сорбционных и десорбционных актов.
В любом варианте хроматографических методов используют сочетание неподвижной фазы (НФ) и подвижной фазы (ПФ). ПФ (газ, жидкость) в процессе хроматографирования непрерывно перемещается вдоль неподвижной фазы (твердое тело, жидкость), так что частицы хроматографируемых веществ, переносимые вместе с ПФ, могут многократно переходить из подвижной фазы в неподвижную и наоборот. Разделение веществ с помощью хроматографии основано на различном сродстве разделяемых веществ к подвижной и неподвижной фазам. Различие в сродстве приводит к различию в скоростях движения частиц разделяемых веществ вместе с подвижной фазой и в итоге к их разделению
Классификация хроматографических методов по механизму разделения веществ:
а) Адсорбционная хроматография − основана на использовании неодинаковой способности разделяемых компонентов вступать в специфическое взаимодействие с поверхностью адсорбента.
б) Распределительная хроматография − основана на использовании различий в коэффициентах распределения разделяемых компонентов между ПФ и НФ, представляющей собой жидкость. За коэффициент распределения принимают отношение равновесной концентрации хроматографируемого вещества в более полярной фазе к равновесной концентрации того же вещества менее полярной жидкой фазе.
в) Ионообменная хроматография − основана на использовании раз личной способности ионов разделяемых компонентов, находящихся в ПФ, к обмену с ионами НФ.
г) Хемихроматография − основана на использовании различной способности компонентов разделяемой смеси вступать в химические реакции с реагентами, входящими в состав НФ. При этом различают такие виды хемихроматорафии, как осадочная, окислительно-восстановительная, комплексообразовательная и биоспецифическая хроматография.
д) Эксклюзионная (ситовая, проникающая) хроматография − основана на использовании различий между размерами частиц разделяемых компонентов и размерами пор НФ, которая представляет собой сорбент − пористое вещество. Сорбенты здесь играют роль молекулярных сит; они проницаемы только для частиц определенных размеров. Мелкие частицы проникают в поры сорбента и удерживаются там, а крупные − уносятся вместе с ПФ, не удерживаясь на сорбенте. Разновидность − гель-хроматография.
е) Электрохроматография (электрофорез), основана на использовании неодинаковой способности разных ионов в растворе перемещаться под действием внешнего электрического поля.
Классификация по технике эксперимента. Обычно различают колоночную, капиллярную, плоскостную (тонкослойную, бумажную) хроматографию.
В случае колоночной хроматографии для разделения компонентов используют хроматографические колонки, заполненные тем или иным сорбентом.
В капиллярной хроматографии в качестве хроматографических колонок применяют капиллярные трубки из стекла или другого материала. При плоскостной хроматографии неподвижной фазой служит либо тонкий слой сорбента, нанесенный на плоскую поверхность − стеклянную, алюминиевую, пластмассовую пластинку (тонкослойная хроматография), либо специальная хроматографическая бумага, волокна которой покрыты тонким слоем воды или другой жидкости (бумажная хроматография). Вдоль плоской поверхности сорбента (НФ) перемещается за счет капиллярных сил жидкая фаза.
Классификация по способу относительного перемещения фаз (по способу получения хроматограммы): фронтальная, элюентная (проявительная), вытеснительная хроматографии.
Одним из наиболее распространенных методов адсорбционной хроматографии является тонкослойная хроматография (ТСХ) разновидность плоскостной хроматографии, при которой адсорбент используют в виде тонкого слоя на пластинке.
На линию старта пластинки наносят пробу, после чего пластинку погружают в хроматографической камере в жидкую фазу ПФ, представляющую собой специально подобранную смесь растворителей. Под действием капиллярных сил ПФ самопроизвольно перемещается вдоль НФ от стартовой линии до линии фронта растворителя, увлекая с собой компоненты пробы, которые перемещаются с различной скоростью. После достижения за время t ПФ линии фронта растворителя хроматографирование прерывают, пластинку извлекают из хроматографической камеры, высушивают на воздухе и определяют положение пятен веществ на поверхности пластинки.
Для характеристики разделяемых компонентов в системе вводят коэффициент подвижности Rf или (Rf - фактор):
![]() (1.1)
, где Vi,
=li/t
и VЕ
= L/t
− соответственно скорости перемещения
i-го
компонента и растворителя Е; li
и L
− путь, пройденный i-м
компонентом и растворителем
соответственно; t
−время, необходимое для перемещения
растворителя от линии старта до линии
фронта растворителя. Расстояния
li
отсчитывают от линии старта до центра
пятна соответствующего
компонента.
(1.1)
, где Vi,
=li/t
и VЕ
= L/t
− соответственно скорости перемещения
i-го
компонента и растворителя Е; li
и L
− путь, пройденный i-м
компонентом и растворителем
соответственно; t
−время, необходимое для перемещения
растворителя от линии старта до линии
фронта растворителя. Расстояния
li
отсчитывают от линии старта до центра
пятна соответствующего
компонента.
В качестве сорбентов чаще всего применяют диоксид кремния − силикагель SiО2 и оксид алюминия А12О3, а также активированный уголь, сахарозу, карбонат кальция, целлюлозу, тальк, полиамидные смолы и т. д.
К распределительной хроматографии относится бумажная хроматография. В методе применяют специальную хроматографическую бумагу, по которой, пропитывая ее, перемещается жидкая ПФ. Различают нормально-фазовую и обращено-фазовую бумажную хроматографию.
В варианте нормально-фазовой бумажной хроматографии жидкой НФ является вода, сорбированная в виде тонкого слоя на волокнах и находящаяся в порах гидрофильной бумаги (до 25% по массе). Роль ПФ, играет другая жидкая фаза, например, органическая жидкость с добавлением кислот и воды. Жидкую органическую ПФ перед хроматографированием насыщают водой для того, чтобы ПФ не растворяла в себе воду, сорбированную на волокнах гидрофильной хроматографической бумаги. В нормально-фазовом варианте в качестве ПФ чаще всего применяют жидкие смеси, составленные из различных растворителей. Классическим примером такой ПФ является смесь уксусной кислоты, н-бутанола и воды в объемном отношении 1:4:5.
В варианте обращено-фазовой бумажной хроматографии жидкая НФ представляет собой органический растворитель, тогда как в роли жидкой ПФ выступает вода, водные или спиртовые растворы, смеси кислот со спиртами. Процесс проводят с использованием гидрофобной хроматографической бумаги. Ее получают обработкой бумаги нафталином, силиконовыми маслами, парафином и т. д. Неполярные и малополярные органические растворители сорбируются на волокнах гидрофобной бумаги и проникают в ее поры, образуя тонкий слой жидкой НФ. Вода не удерживается на такой бумаге, не смачивает ее. Техника бумажной хроматографии в общих чертах такая же, как и в методе ТСХ. Бумажная хроматография подобно методу ТСХ применяется как в качественном, так и в количественном анализе.
4. Иллюстративный материал:
Рис. 1. Схема разделения компонентов А и В.
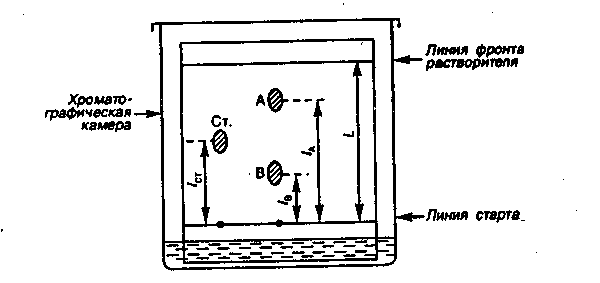
5. Литература:
Основная: 1, 2, 3, 4, 5.
Дополнительная: 7, 8.
6. Контрольные вопросы:
Классификация хроматографических методов анализа.
Основные теоретические принципы хроматографии.
Адсорбционная хроматография.
Колоночная хроматография.
Бумажная хроматография.
Тонкослойная хроматография.
1. Лекция 5. Подготовка образца к анализу. Применение химических и физико-химических методов анализа для идентификации веществ.
2. Цель лекции: Рассмотреть общую схему подготовки образцов к анализу. Дать понятие о физико-химических методах анализа, применяющихся для идентификации веществ.
3. Тезисы лекции: В общем случае ход качественного химического анализа вещества включает следующие основные этапы: подготовка вещества к анализу и отбор средней пробы; предварительные наблюдения и испытания: перевод анализируемого образца в раствор; открытие катионов; открытие анионов.
Твердый анализируемый объект внимательно осматривают, определяя его внешний вид, цвет, запах, степень измельчения, наличие кристаллических или аморфных фаз. Затем образец рассматривают в лупу и под микроскопом. По окраске анализируемого образца иногда можно высказать предположения о наличии или отсутствии в нем тех или иных катионов.
После проведения тщательного осмотра твердый образец растирают в порошок в ступке или в специальных мельницах и просеивают полученный порошок через сито с определенным размером отверстий. Более крупные частицы, оставшиеся на сите, снова растирают и просеивают до тех пор, пока весь порошок пройдет через сито. Полученный порошок тщательно перемешивают и отбирают среднюю пробу, например, методом квартования.
Для проведения полного качественного химического полумикроанализа достаточно взять среднюю пробу массой не более 0,1-0,3 г, а аналитическую пробу (отбираемую из средней пробы) − до 20-30 мг, в зависимости от природы анализируемого объекта и метода анализа.
После отбора пробы проводят предварительные наблюдения и испытания. К ним относят следующие испытания:
1). Окрашивание пламени газовой горелки.
2) Испытание на продукты термического разложения.
3) Испытание на окрашивание фосфатных и боратных перлов.
4) Действие разбавленной (~1 моль/л) серной кислоты.
5) Действие концентрированной серной кислоты.
Предварительные наблюдения и испытания позволяют сделать предположения и выводы о наличии тех или иных катионов и анионов в анализируемом образце. Дальнейшее подтверждение этих предположений и выводов, а также прямые доказательства присутствия катионов и анионов получают при проведении дробного или систематического анализа. Для этого анализируемый твердый образец вначале переводят в раствор, подбирая подходящий растворитель.
Растворимость анализируемого вещества в различных растворителях исследуют, отбирая небольшие порции его (2-5 мг) в следующем порядке: растворение в воде, растворение в кислотах (разбавленной уксусной кислоте, разбавленных и концентрированных НС1 и HNO3), растворение в щелочах и аммиаке.
Для перевода твердого анализируемого образца, нерастворимого в воде и в кислотах, его сплавляют с NaHCО3, Na2CО3, К2СО3, щелочами, KHSО4, K2S2Q7 а также со смесями соды с окислителями (КClO3, KNO3, NaBiO3, Na2O2) и т. д. При таком сплавлении компоненты твердого анализируемого образца, нерастворимые в воде и в кислотах, превращаются в продукты реакций, растворяющиеся в кислотах.
После растворения исходного анализируемого образца получают один или несколько растворов, в которых открывают катионы, проводя дробный или систематический анализ катионов соответствующими методами. При этом учитывают данные предварительных наблюдений и испытаний.
Анионы открывают в растворах, полученных при растворении исходного анализируемого объекта, используя дробный метод обнаружения с учетом сведений предварительных испытаний, а также данных, полученных при открытии катионов.
Помимо химических методов в качественном анализе, применяются различные физико-химические и физические методы. Наиболее широкое распространение получили три группы таких методов − оптические, хроматографические и электрохимические; реже привлекаются и некоторые другие.
Оптические методы анализа основаны на измерении характеристик оптических свойств вещества (испускание, поглощение, рассеивание, отражение, преломление, дифракция, интерференция, поляризация света), проявляющихся при его взаимодействии с электромагнитным излучением. По характеру взаимодействия электромагнитного излучения с веществом оптические методы анализа обычно подразделяют на эмиссионный спектральный, атомно-абсорбционный, молекулярный абсорбционный спектральный (спектрофотометрия, фотоэлектроколориметрия), люминесцентный, нефелометрический, турбодиметрический, рефрактометрический, интерферометрический, поляриметрический анализ и т. д.
Из хроматографических методов в качественном анализе чаще всего применяют тонкослойную, бумажную, осадительную, газовую адсорбционную, газожидкостную, высокоэффективную жидкостную хроматографию (жидкостную хроматографию высокого давления).
Применение ГАХ, ГЖХ и ВЭЖХ в качественном анализе основано на измерении времени удерживания (или расстояния удерживания) для данного компонента на хроматограмме анализируемой смеси. В данных условиях хроматографирования оно является характерной величиной, специфичной для каждого вещества. ГАХ и ГЖХ используют для открытия и определения остаточных растворителей в лекарственных препаратах.
Из электрохимических методов в качественном анализе применяют преимущественно электрофорез и полярографию. Другие методы используются реже. Использование полярографии в качественном анализе основано на определении потенциала полуволны Е1/2 на полярограмме анализируемого раствора. Потенциал полуволны является специфической характеристикой каждого вещества (например, катиона) при проведении анализа в заданных условиях. Сравнивая полученные в одинаковых условиях потенциалы полуволны на полярограммах анализируемого раствора и раствора-свидетеля, содержащего предполагаемый катион, можно сделать вывод о присутствии или отсутствии данного катиона в анализируемом растворе. Практически для всех катионов металлов и для многих других веществ разработаны методики полярографического анализа.
