
- •- Этилхлорид из этилового спирта.
- •- Этанол и этилен из этилхлорида.
- •- Пропанол и из соответствующего галогеналкана.
- •- Пропилхлорид из пропанола.
- •- Соответствующие спирты из пропилхлорида и аллилхлорида;
- •- Метилйодида с водным раствором гидроксида натрия.
- •- Этилат натрия с этилйодидом.
- •- Пропилбромид с этоксидом натрия.
- •- Реакции этилирования аммиака.
- •- Этаналь
- •- Пропаналь
- •- Бутаналь
- •- Полный этиловый эфир бутандиовой кислоты из бутандиовой кислоты
- •- Метилацетат
- •- Этиловый эфир пропановой кислоты
- •- N-метиламид уксусной кислоты
- •- Метилбутаноат
- Этаналь
- Пропаналь

- Бутаналь

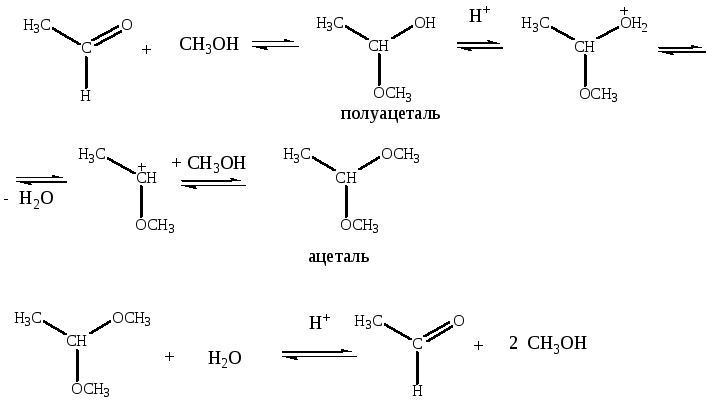
Спирты в результате присоединения к альдегидам и кетонам образуют с одной молекулой спирта неустойчивые полуацетали и полукетали, с двумя — устойчивые ацетали и кетали. Реакции образования полуацеталей катализируются кислотами и основаниями. Эта реакция обратима — ацетали гидролизуются под действием кислот.
Механизм реакции обратен механизму гидролиза ацеталей.

Ацетали образуются при действии избытка спирта только в кислой среде. Обратная реакция гидролиза ацеталей тоже катализируется кислотами.

При щелочном гидролизе уходящая группа (RO–) является очень плохой, и реакция невозможна. Это свойство — устойчивость ацеталей в щелочной среде — используется, когда необходимо защитить карбонильную группу.
5.Напишите схемы реакций взаимодействия:
- бензальдегида с метиламином
- бутаналя с метантиолом в мольном отношении 1:2
- бутаналя с этиламином
- пропаналя с гидроксиламином
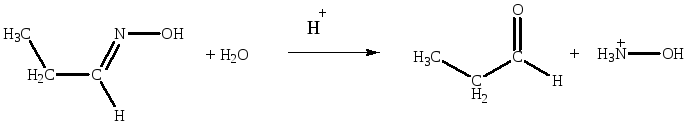
Опишите механизм реакций. Способны ли гидролизоваться полученные соединения? Напишите схемы реакций гидролиза.
Решение




Имины, оксимы по реакциям, обратным их образованию могут подвергаться гидролизу водными кислотами. Гидролиз можно рассматривать как катализируемое кислотами присоединение воды к гетероаналогу карбонильного соединения.
Тиоацетали, также могут быть подвергнуты гидролизу.



Карбонильная группа содержит двойную углерод-кислородную связь; поскольку подвижные π-электроны сильно оттянуты к кислороду, углерод карбонильной группы является электрон-дефицитным центром, а кислород карбонильной группы — электроноизбыточным.
Поскольку важнейшая стадия в этих реакциях — образование связи с электронодефецитным (кислым) карбонильным углеродом, то карбонильная группа более всего склонна к взаимодействию с электроноизбыточными нуклеофильными реагентами, т. е. с основаниями. Типичными реакциями альдегидов и кетонов будут реакции нуклеофильного присоединения.

В переходном состоянии кислород начинает приобретать электроны и отрицательный заряд, который он будет иметь в конечном продукте. Именно тенденция кислорода приобретать электроны, точнее его способность нести отрицательный заряд, и является действительной причиной реакционной способности карбонильной группы по отношению к нуклеофилам.
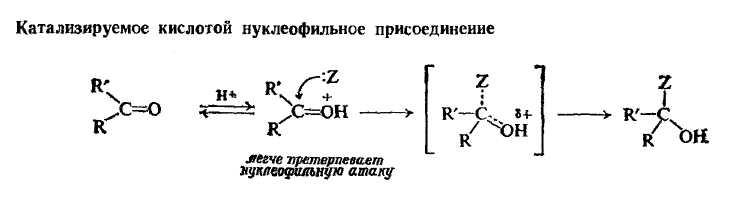
Оксимы и тиоацетали образуются по этому механизму.
6.Напишите схемы реакций альдольной конденсации
- этаналя
- 2-метилпропаналя
- бутаналя
- пентаналя
Опишите механизмы реакций, объясните причину появления CH- кислотного центра.
Решение
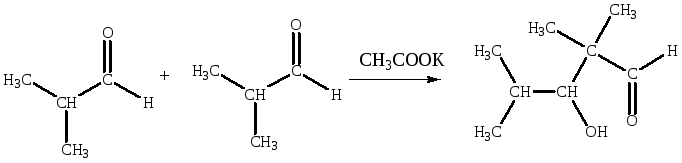
На присоединении сопряженного карбаниона генерированного из альдегида или кетона, к карбонильной группе основывается важная реакция — альдольная конденсация (правильнее было бы называть эту реакцию альдольным присоединением):

В некоторых случаях альдольное присоединение происходит в присутствии кислого катализатора. При этом нейтральный и слабый С-нуклеофил — енол — присоединяется к активированной карбонильной группе.
Для проведения реакций используют слабощелочную среду.



Ионизация α-водородного атома

приводит к карбаниону I, представляющему собой резонансный гибрид двух структур (II и III), резонанс которых возможен лишь при участии карбонильной группы

Резонанс подобного типа невозможен для карбанионов, образующихся при ионизации β- и γ-водородных атомов и т. д. в насыщенных карбонильных соединениях.
Таким образом, карбонильная группа влияет на кислотность α-водородных атомов точно так же, как она влияет на кислотность карбоновых кислот: группа С=О участвует в делокализации отрицательного заряда аниона

Альдегидная группа обладает также отрицательным индуктивным эффектом (–I), что также влияет на усиление кислотных свойств α-водородных атомов.
α-Водородные атомы карбонильных соединений все же слабо кислые, хотя и обладают кислотностью достаточной для того, чтобы они отрывались при действии основных реагентов. Поэтому образующиеся карбанионы будут сильными основаниями и исключительно реакционноспособными частицами. В реакциях они ведут себя, как и следовало ожидать, как нуклеофилы.
7.Напишите схемы внутримолекулярных превращений, которым подвергаются в кислой среде:
- 4-гидрокси - 3-метилпентаналя
- 5-гидроксигексаналя
Опишите механизм реакций. В чём причина этого внутримолекулярного взаимодействия? Способны ли гидролизоваться полученные соединения?
Решение
γ- и δ-Гидроксикарбонильные соединения легко образуют продукты внутримолекулярного взаимодействия гидроксильной группы с карбонильной — циклические полуацетали. Эти соединения могут существовать в форме с открытой цепью и в циклической полуацетальной форме. Такое явление называется кольчато-цепнойизомерией. В отдельных случаях наблюдается равновесие между циклическими и открытыми формами.
γ-Гидроксикарбонильные соединения образуют производные тетрагидрофурана.
δ-Гидроксикарбонильные соединения образуют цикл тетрагидропирана, точнее производные 2-гидрокситетрагидропирана, в которых появляется асимметрический атом углерода.
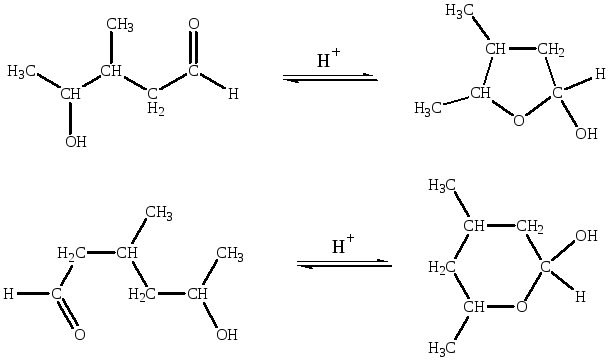
Это реакции внутримолекулярного нуклеофильного присоединения с кислотным катализом.
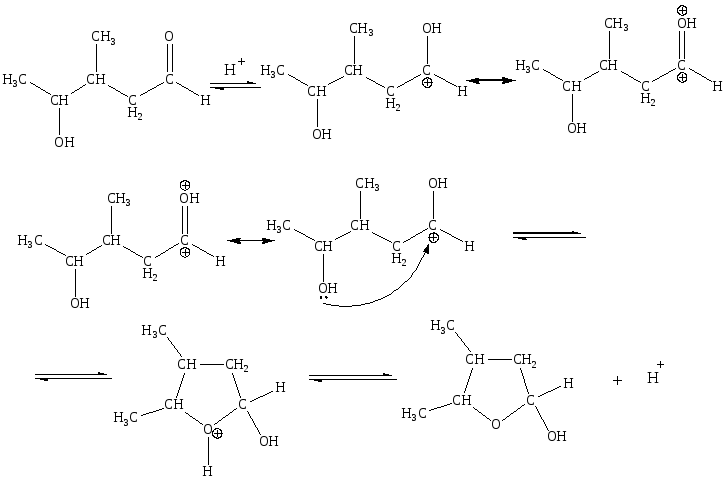
Гидролиз этих соединений протекать не может, так как в процессе реакции не образовывалось воды (вода не отщеплялась).
8.Напишите схемы реакций получения:
- полного этилового эфира бутандиовой кислоты из бутандиовой кислоты
- полного амида бутандиовой кислоты из полного метилового эфира той же кислоты
- метилацетата из соответствующей карбоновой кислоты и ангидрида
- ацетамида из соответствующих функциональных производных: сложного эфира и ангидрида
- метилацетата по реакции этерификации
- сложного эфира из бутановой кислоты и этилового спирта
- пропанамида из различных ацилирующих агентов: кислоты, ангидрида, сложного эфира
- ангидридов бутановой и бутандиовой кислот из соответствующих кислот
Опишите механизмы реакций. Объясните необходимость катализатора в реакции этерификации.
Решение
