
- •- Этилхлорид из этилового спирта.
- •- Этанол и этилен из этилхлорида.
- •- Пропанол и из соответствующего галогеналкана.
- •- Пропилхлорид из пропанола.
- •- Соответствующие спирты из пропилхлорида и аллилхлорида;
- •- Метилйодида с водным раствором гидроксида натрия.
- •- Этилат натрия с этилйодидом.
- •- Пропилбромид с этоксидом натрия.
- •- Реакции этилирования аммиака.
- •- Этаналь
- •- Пропаналь
- •- Бутаналь
- •- Полный этиловый эфир бутандиовой кислоты из бутандиовой кислоты
- •- Метилацетат
- •- Этиловый эфир пропановой кислоты
- •- N-метиламид уксусной кислоты
- •- Метилбутаноат
- Метилйодида с водным раствором гидроксида натрия.
![]()
Гидролиз метилйодида протекает по механизму бимолекулярного нуклеофильного замещения SN2.
Образование новой ковалентной связи С—Oи разрыв связи, С—Iпроисходят синхронно, а скорость всего процесса определяется скоростью образования переходного состояния.
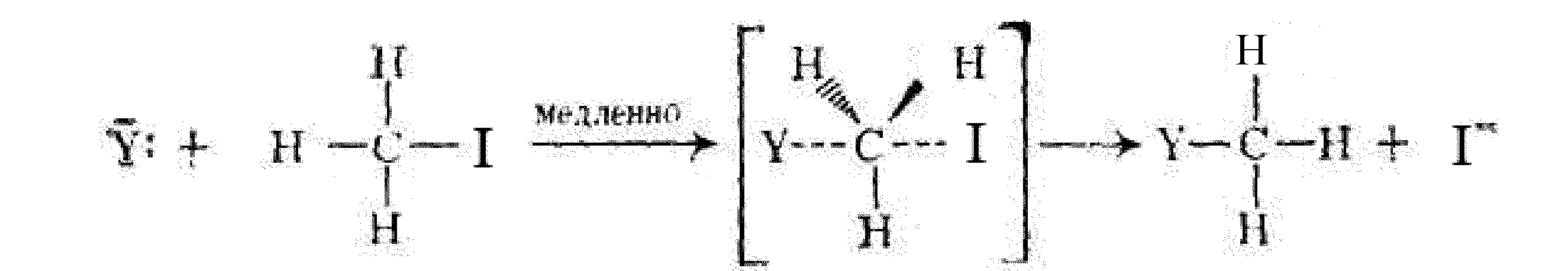
Полученное вещество метанол (метиловый спирт) относится к классу насыщенных спиртов.
- Этилат натрия с этилйодидом.
![]()
Реакция Вильямсона протекает по механизму бимолекулярного нуклеофильного замещения SN2.
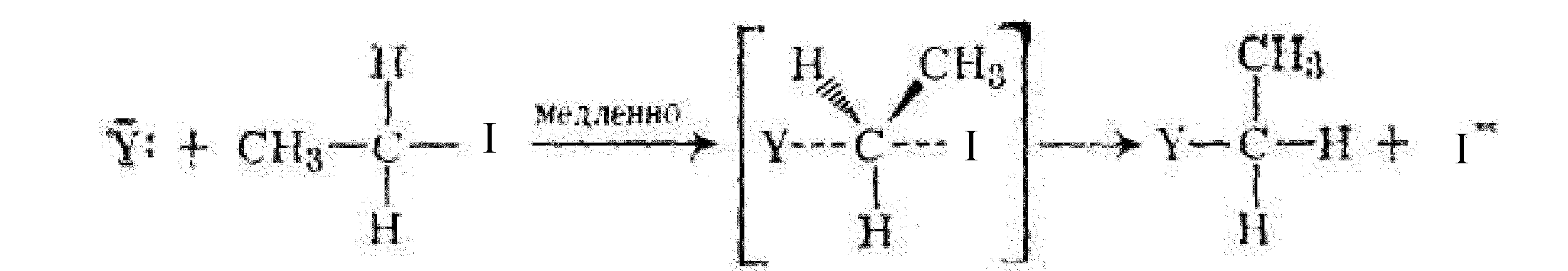
Y–: – алкоголят анионC2H5O –(нуклеофил).
Образующийся в результате реакции диэтиловый эфир относится к классу насыщенных простых эфиров.
- Пропилбромид с этоксидом натрия.
![]()
Это тоже реакция Вильямсона протекает по механизму бимолекулярного нуклеофильного замещения SN2. Так как алкилбромиды менее реакционноспособны, чем иодиды, то в реакционную массу вносят немного безводного иодида калия.
Механизм аналогичен предыдущей реакции, только вместо этилиодида, н-пропилбромид.
Пропилэтиловый эфир относится к классу простых эфиров.
- Реакции этилирования аммиака.
При реакции аммиака с алкилгалогенидами вначале образуются первичные алкиламины, причем первоначально образуется соль аммония, которая разлагается избытком аммиака:
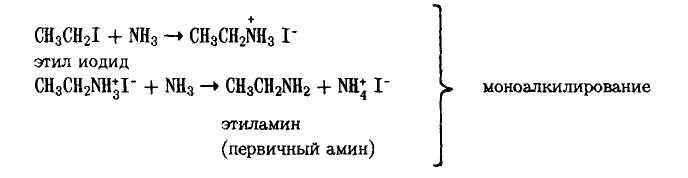
Первичный амин, будучи более сильным нуклеофилом, чем аммиак, вступает с ним в конкуренцию и реагирует со следующей молекулой алкилгалогенида (аминолиз) Образующаяся соль, как и в предыдущем случае, разлагается аммиаком
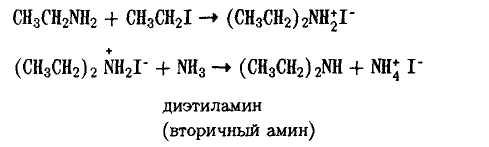
Далее также реагирует вторичный амин (аминолиз)
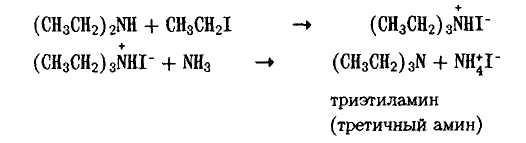
Третичный амин также способен вступать в реакцию с алкилгалогенидом, образуя четвертичную соль, которая уже не разлагается под действием аммиака
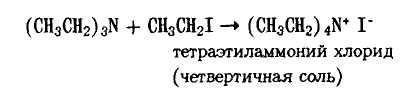
Поэтому эту реакцию используют для получения третичных аминов и четвертичных аммониевых солей.
Реакция протекает по механизму бимолекулярного нуклеофильного замещения SN2.
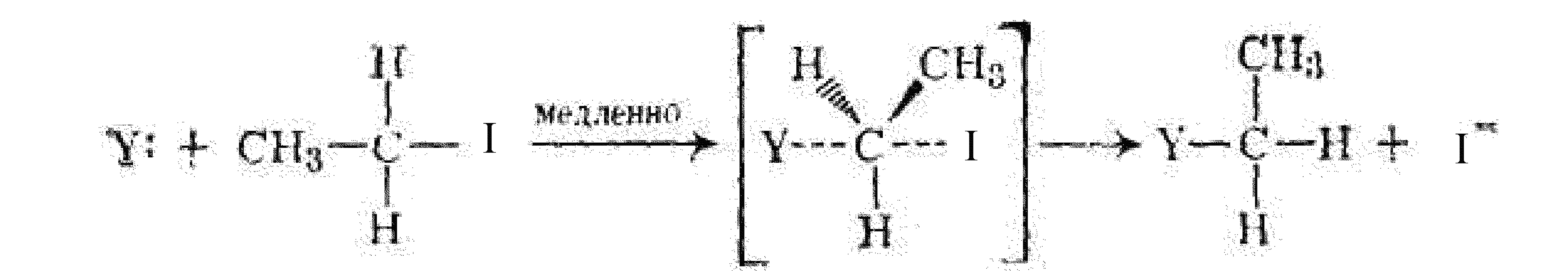
Y: – аммиак или амин (нуклеофил).
Образующиеся соединения относятся к классу предельных аминов
3.Напишите схемы реакций и межмолекулярной дегидратации:
- этанола
- пропанола-1
- изопропилового спирта
- бутанола-1
- бутанола-2
- яблочной (гидроксибутандиовой) кислоты
Опишите механизм реакций. В каких условиях протекают реакции? Нуклеофильные или электрофильные свойства проявляют молекулы спиртов? Какие из полученных продуктов могут существовать в виде диастериомеров?
Решение
![]()
![]()
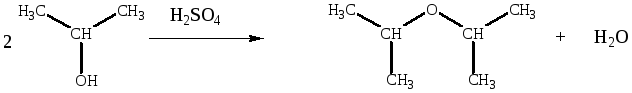
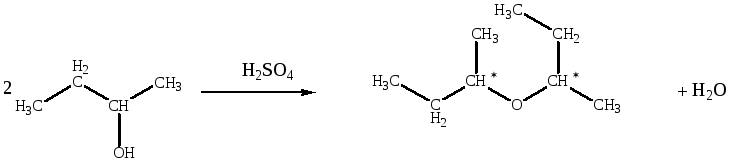
Реакция дегидратации вторичного спирта может сопровождаться перегруппировками, в результате образования вторичного карбкатиона по механизму SN1. Кроме того, идут побочные реакции образования алкенов. Ди-2-бутиловый эфир имеет два асимметрических атома углерода, поэтому возможно наличие энантиомеров и диастереомеров.
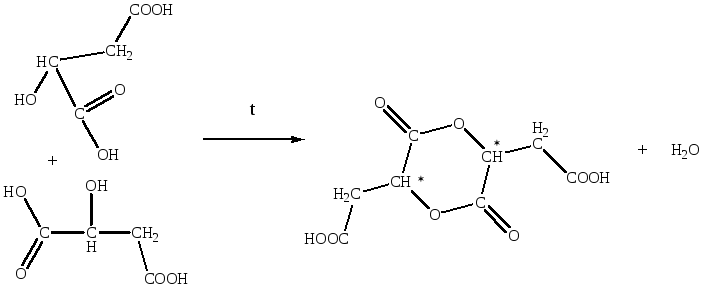
Яблочная кислота при нагревании до 100ºС, превращается в ангидрид, подобный лактидам. Полученный лактид обладает оптической активностью, благодаря наличию двух асимметрических атомов углерода, поэтому для этого соединения возможно наличие диастереомеров — оптических изомеров не являющихся оптическими антиподами.
Образование эфиров, а не алкенов при дегидратации достигается выбором соответствующих условий реакции. Например, этилен получают нагреванием этилового спирта с концентрированной серной кислотой при 180 °С; диэтиловый эфир образуется при нагревании смеси этилового спирта и концентрированной серной кислоты при 140 °С, причем добавляют все время спирт, чтобы он был в избытке. Кроме серной кислоты применяют безводную фосфорную кислоту оксид или фосфат алюминия.
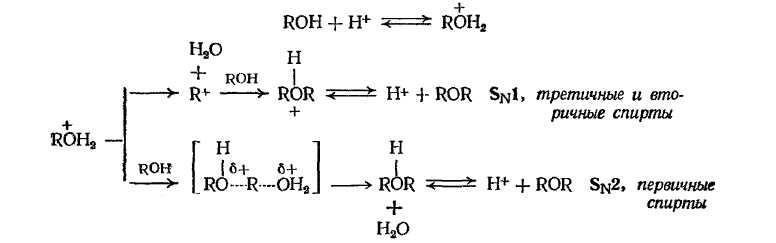
Образование простого эфира при дегидратации служит примером реакции нуклеофильного замещения, в которой протонированный спирт выступает в качестве субстрата, а вторая молекула спирта — в роли нуклеофила. Реакция может протекать по механизму SN1 или SN2 в зависимости от того, потеряет ли протонированный спирт молекулу воды раньше или одновременно с атакой второй молекулой спирта. Вторичные и третичные спирты, вероятно, реагируют по SN1-механизму
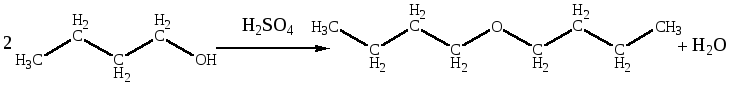
Однако из н-бутилового спирта получается ди-н-бутиловый эфир, т. е. реакция, протекает без перегруппировки и, следовательно, преимущественно без образования промежуточных карбониевых ионов; очевидно, первичные спирты, для которых вероятность образования карбониевых ионов наименьшая, а склонность к атаке с тыла наибольшая, реагируют по SN2-механизму.
Подробнее, взаимодействие первичных спиртов с серной кислотой начинается с протонирования атома кислорода гидроксигруппы. Так как последующее образование первичного карбокатиона RCH2+энергетически невыгодно, есть основания утверждать, что реакция протекает по механизму SN2 с промежуточным образованием алкилсерной кислоты:
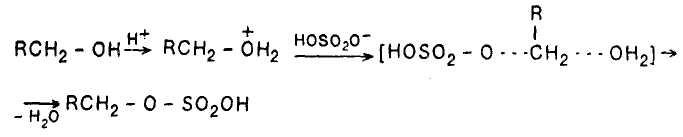
В алкилсерной кислоте, которую можно рассматривать как продукт замещения атома водорода в гидроксильной группе спирта на электроноакцепторную группу X, на атоме углерода, связанном с группой ОН, создается значительный положительный заряд, и она способна реагировать даже с таким сравнительно слабым нуклеофилом, как спирт:
![]()
Поскольку в результате реакции регенерируется молекула серной кислоты, есть основания предполагать, что нуклеофильная атака молекулы спирта с вытеснением гидросульфат-аниона и депротонирование гидроксильной группы спирта происходят синхронно через шестичленное переходное состояние, например:
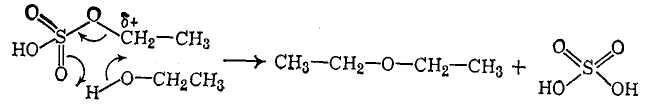
4. Напишите уравнения реакций получения полного ацеталя через стадию образования полуацеталя при взаимодействии с метанолом:
- этаналя
- пропаналя
- бутаналя
Опишите механизм реакции. Способны ли гидролизироваться полученные соединения? Напишите схемы реакций гидролиза.
Решение
Образование и гидролиз. Полученные соединения при нагревании гидролизуются разбавленными минеральными кислотами (но не щелочами) с образованием спирта и альдегида.
