
Наглядная химия. Электронная структура атома углерода в органических соединениях (pdf)
.pdf
11
H H H |
H H |
H H |
H |
|
C |
C C |
C C C C C |
||
H |
H |
H H |
H H |
H H |
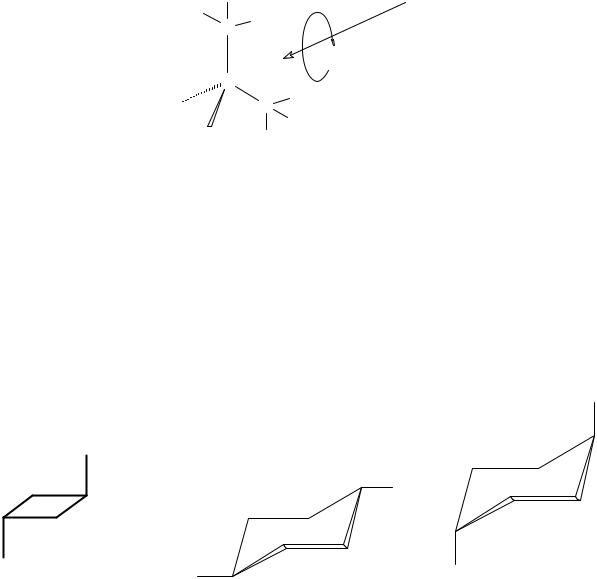
Рис. 11. Наиболее стабильная, так называемая зизгзагообразная конформация неразветвленных алканов
Конформационный анализ
Заторможенное вращение вокруг простой связи
R
R
R
R
Пространственная изомерия, стереоизомерия
Цис-транс-изомерия Оптическая изомерия
Оптическая, или зеркальная, изомерия
Био (1815)

12
Рис. 12. Схематическое изображение электромагнитных колебаний в луче обыкновенного и поляризованного света; 1 – в обыкновенном свете; 2 – в поляризованном свете; 3 – плоскость поляризации; 4 - призма Николя
Антиподы или энантиомеры (от греч. enantio —
противоположный).
Рацемическая смесь, или рацемат

13
Рис. 13. Изменение плоскости поляризации при прохождении поляризованного света через оптически активные вещества: 1 – оптически активное вещество, 2 – первоначальная плоскость поляризации, повернутая на угол α после прохождения света через оптически активное вещество.
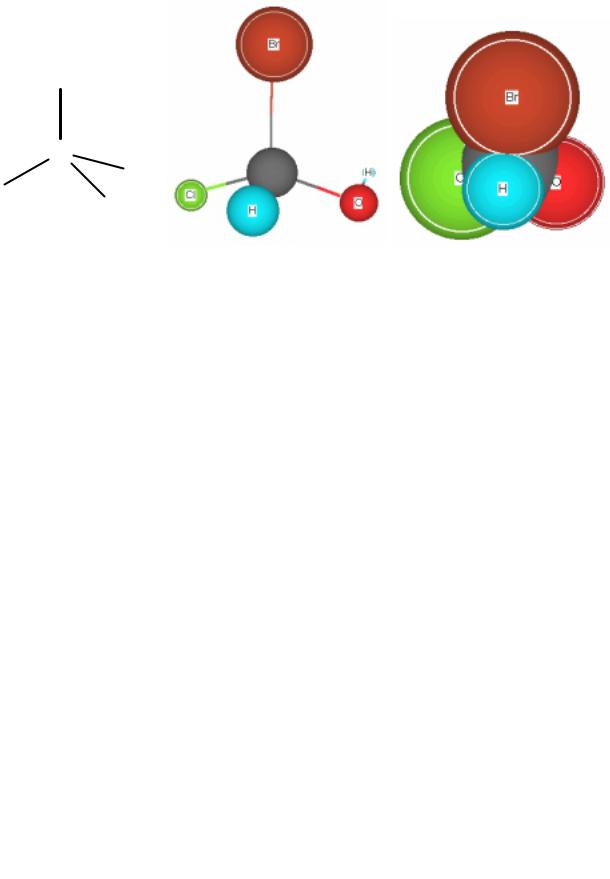
Тетраэдрическая теория Я. Вант-Гоффа и А. Ле-Беля (1874) Асимметрический атом углерода
Рис. 14. Модели асимметрического атома углерода: а - тетраэдрическая; б - шаростержневая
14
H
|
C |
Cl |
HO |
|
|
|
Br |
|
|
|
бромхлорметанол
Рис. 15. Несовместимость оптических изомеров
15
Хиральный (от греч. хейрос — рука, рукоподобие)
Оптическая изомерия — это явление, обусловленное хиральностью.
Проекционные формулы (Э. Фишер)
C H 3 |
|
|
CH |
|
COOH |
Молочная кислота |
|||||
|
|
||||||||||
|
|
α -гидроксикоричная кислота |
|||||||||
|
|
OH |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
C O O H |
|
COOH |
||||
|
|
|
H |
|
* |
OH |
HO |
|
* |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
CH3 |
|||
|
|
|
|
|
3 |
|
|
|
|
||
|
D(–)-молочная кислота |
L(+)-молочная кислота |
|||||||||
М.А. Розанов, 1906 |
|
|
|
|
|||||||
|
|
|
H |
|
O |
H |
|
O |
|||
|
|
|
|
|
C |
|
C |
||||
|
|
|
H |
C OH |
HO |
C H |
|||||
|
|
|
|
|
CH2OH |
|
CH2OH |
||||
D(+)–глицериновый альдегид |
L(–)–глицериновый альдегид |
16
Л. Пастер, 1848
Рис. 16. Энантиоморфные формы кристаллов
CH2 CH2 COOH
OH
β гидроксипропионовая кислота
N = 2n
|
COOH |
|
COOH |
COOH |
|
COOH |
||
H |
C |
OH |
HO |
C H |
H C OH |
HO |
C |
H |
HO |
C |
H |
H |
C OH H C OH |
HO |
C |
H |
|
|
COOH |
|
COOH |
COOH |
|
COOH |
||
|
|
|
|
|
|
|
|
|
|
I |
|
|
II |
III |
|
IV |
|
D(+)-винная |
L(-)-винная |
мезовинная кислота |
|
|||||
|
кислота |
кислота |
|
|
|
|
||
|
|
|
|
|
|
|
||
виноградная кислота
1) |
+ |
2) |
– |
3) |
+ |
4) |
– |
|
+ |
– |
– |
+ |
|||||
|
|
|
|

17
Стереоизомеры, которые, не являются энантиомерами,
называются диастереомерами.
Относительная и абсолютная конфигурация.
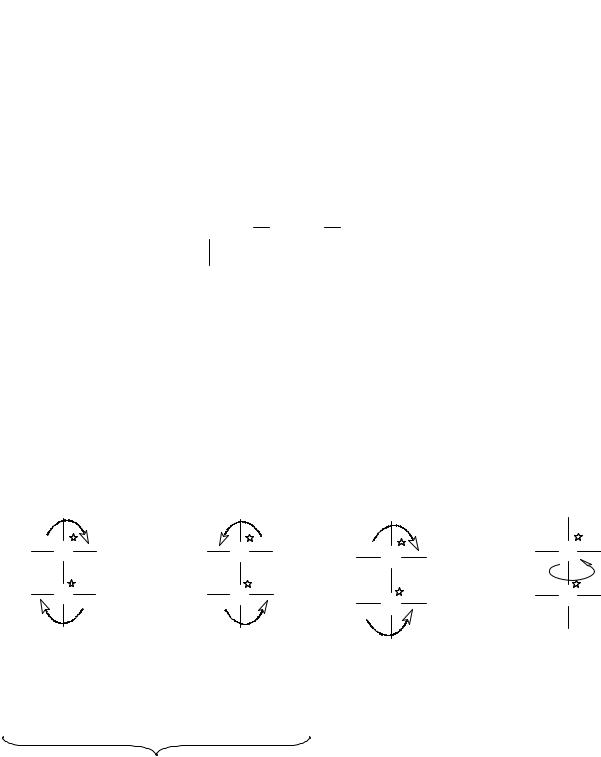
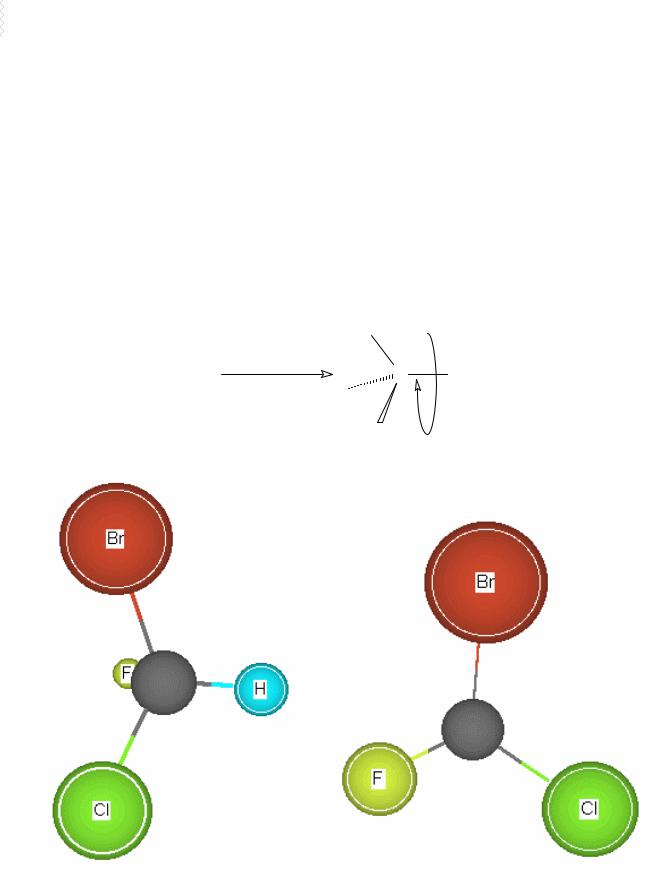
Определение абсолютной конфигурации по системе Кана — Ингольда — Прелога
R (от латинского rectus — правый) S (от латинского sinister — левый)
Рацемическую модификацию обозначают R, S
Рис. 17. Определение абсолютной конфигурации хирального центра после установления старшинства заместителей
18
Правила старшинства:
1.Атом с большим атомным номером является старшим (т.е. имеет относительное старшинство) относительно атома с меньшим атомным номером.
2.Большее массовое число имеет преимущество перед меньшим. Этот пункт относится к изотопам.
3.Несвязанные электроны уступают старшинство атомам и имеют более низкий порядок, чем, например, атом водорода.
направление Br
взгляда
C H
F
Cl
(R)-бромхлорфторметан
19
направление
CH3 взгляда
CH3 C H
|
C |
H |
H |
C |
|
Br |
|
CH |
H |
3 |
|
|
|
(R)-3-бром-2-метилпентан
Br > (CH3)2CH > CH3CH2 > H
цис-транс- Изомерия в кольце
CH3
CH3
CH3
CH3 |
CH3 |
CH3 |
транс-1,3- диметилциклобу транс-1,4-диметилциклогексан
цис-1,4-
тан
диметилциклогексан
20
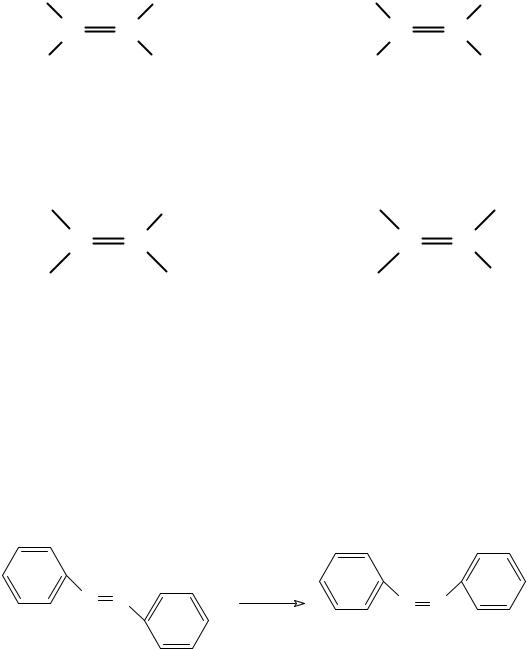
цис-транс- Изомеры относительно двойной связи (E/Z- изомерия)
H3C |
CH3 |
H3C |
H |
C |
C |
C |
C |
H |
H |
H |
CH3 |
цис-бутен-2 |
транс-бутен-2 |
||
Br |
F |
Br |
I |
C |
C |
C |
C |
Cl |
I |
Cl |
F |
(Z)-1-бром-1-хлор-2-фтор-2- |
(E)-1-бром-1-хлор-2-фтор-2- |
||
иодэтен |
иодэтен |
||
Е (от нем. entgegen—напротив)
Z (от нем. zusammen—вместе).
N N |
hv |
N N |
анти-азобензол |
син-азобензол |
