
Наглядная химия. Электронная структура атома углерода в органических соединениях (pdf)
.pdf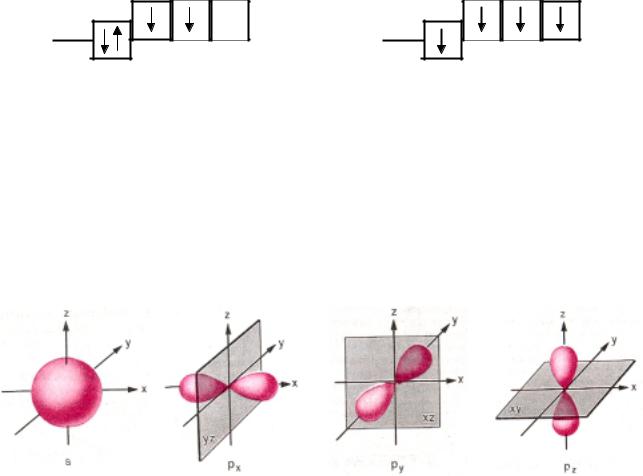
1
Электронная структура атома углерода в органических соединениях
ЭЛЕКТРОННАЯ СТРУКТУРА АТОМА УГЛЕРОДА



 2s2 2px1 2py1 2pz0 1s2
2s2 2px1 2py1 2pz0 1s2
Основное состояние



 2s1 2px1 2py1 2pz1 1s2
2s1 2px1 2py1 2pz1 1s2
Возбужденное состояние
Атомная орбиталь — это часть пространства, в которой вероятность нахождения электрона максимальна.
Рис. 1. Атомные s- p-орбитали
2
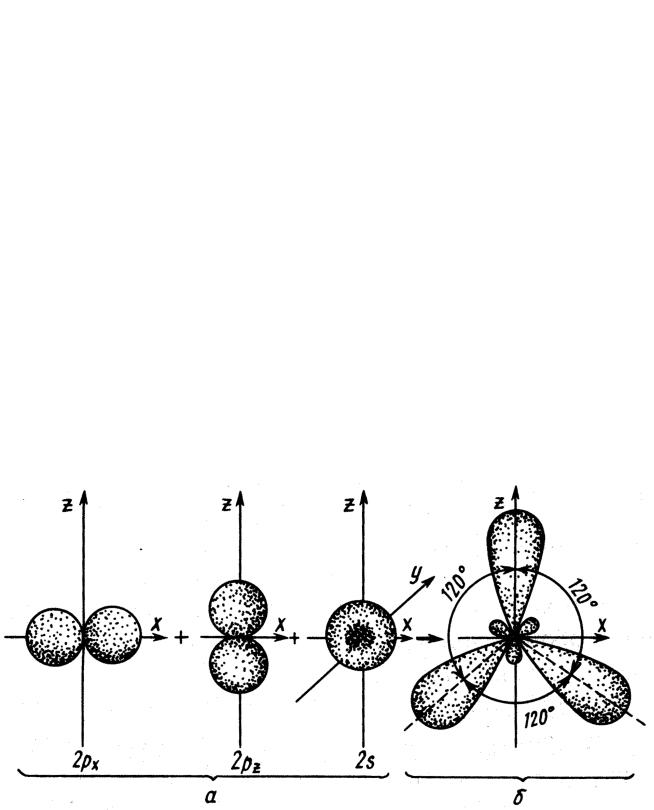
sp3-Гибридизация
Рис. 2. Схема образования четырех sp3-гибридных орбиталей: а - негибридизованные орбитали атома углерода; б - орбитали атома углерода в состоянии sp3-гибридизации
sр2-Гибридизация
Рис. 3. Схема образования трех sр2-гибридных орбиталей: a - негибридизованные орбитали атома углерода; б - орбитали атома углерода в состоянии sp2-гибридизации.
3
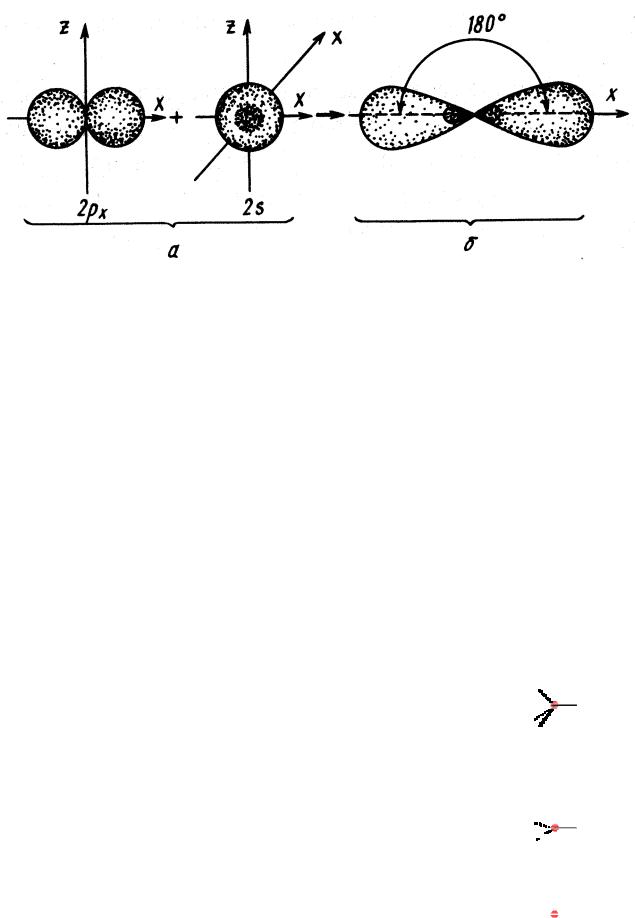
sp-Гибридизация
Рис. 4. Схема образования двух sp-гибридных орбиталей: а - негибридизованные орбитали атома углерода; б - орбитали атома углерода в состоянии sp-гибридизации
Таблица 1. Гибридные орбитали и характер углеродных атомов
Состояние |
|
|
|
|
|
Валентное |
|
Тип |
|||||||||
|
Орбитали |
состояние |
гибридизации и |
||||||||||||||
углеродного атома |
|
атома |
строение |
||||||||||||||
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
углерода |
молекулы |
||||||||||
Возбужденное, |
2s |
|
2px |
2py |
2pz |
– |
|
|
|
|
|
|
|
|
– |
||
исходное состояние |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
(sp3) |
|||||||||||
Возбужденное, в |
|
|
|
|
|
|
|||||||||||
алканах |
2sp |
2sp |
2sp |
2sp |
I |
Тетраэдрическое |
|||||||||||
|
3 |
|
3 |
3 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Возбужденное, в |
|
|
|
|
|
|
(sp2) |
||||||||||
|
|
|
|
|
|
||||||||||||
алкенах |
2sp |
2sp |
2sp |
2p |
II |
Тригональное |
|||||||||||
|
2 |
|
2 |
2 |
(плоскостное) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Возбужденное, в |
|
|
|
|
|
|
(sp) Дигональное |
||||||||||
алкинах |
2sp |
2sp |
2p |
2p |
III |
(линейное) |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
Типы химической связи. Ковалентная связь
Ионная (электровалентая) связь
Na + Cl |
Na + |
Cl - |
Ковалентная (неэлектровалентная) связь
A + B |
A : B |
Молекулярная орбиталь
H |
+ |
H |
H : H |
или |
H |
H |
|
|
|
|
H |
|
H |
|
|
4H |
+ |
C |
или |
H C |
H |
||
H C H |
|||||||
|
|
|
H |
|
H |
|
|
|
|
|
|
|
|
H |
H |
или |
H |
C |
H |
H |
C :: C |
|
C |
||
H |
|
H |
|
H |
|
H : C ::: C : H |
или |
H |
C |
C H |
|
водород
метан
этилен
ацетилен
5
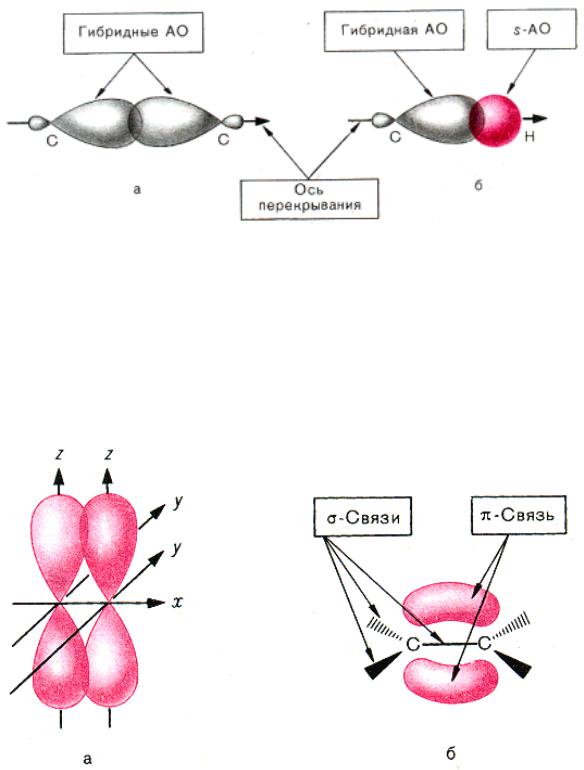
σ (сигма)-связь
Рис. 5. Различные виды перекрывания орбиталей при образовании (σ -связей: а - перекрывание двух sр3-гибридных орбиталей атомов углерода (С-С); б - перекрывание 1s-ор6италей атома водорода с sр3-гибридной орбиталью атома углерода (С-Н))
π (пи)-связь
Рис. 6. Перекрывание двух негибридизованных 2р-орбиталей в молекуле этилена: а - объемное изображение двух перекрывающихся негибридизованных 2р-орбиталей; б - области максимальной электронной плотности лежат над и под плоскостью расположения σ - связей атомов углерода.
6
а) |
б) |
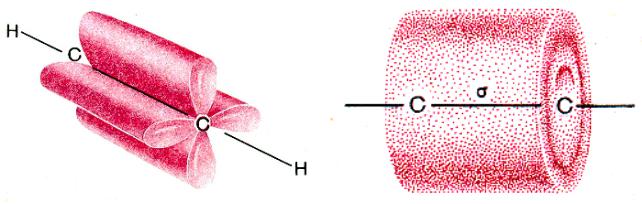
Рис. 7. Перекрывание четырех негибридизованных 2р-ор6италей в молекуле ацетилена: а - объемное изображение четырех перекрывающихся 2р-орбиталей; 6 - схематическое изображение этих орбиталей в двух взаимно перпендикулярных плоскостях
π -связь менее прочна, чем σ -связь, а ее электроны легче смещаются в сторону одного из углеродных атомов.
Полярность связи
F > O > С1 > N > Вг > С > Н
7
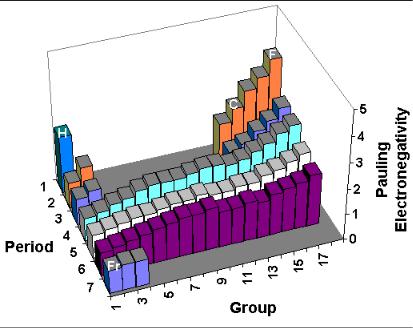
Электроотрицательность
Рис 8. Изменение электроотрицательности (по Полингу) элементов в зависимости от их положения в таблице Д.И. Менделеева
С( sp) > C( sp2 ) > C( sp3 )
δ + δ −
H3C Cl
Cl
Электрический момент диполя (дипольный момент)
= e r
где — электрический момент диполя (векторная величина),
Кл м (или дебаях (D); 1D = 3.34 10-30 Кл м); е — элементарный заряд; r — расстояние между центрами тяжестей всех зарядов.
8
Поляризуемость — способностью изменять свою полярность, например, под влиянием внешнего воздействия
Таблица 2. Некоторые параметры ковалентных углерод-углеродных связей
|
|
|
Тип |
|
Угол между |
Энергия |
|
|
Ковалентн |
гибриди- |
Длина |
гибридными |
связи, |
Форма |
|||
ая связь |
зации |
связи, |
орбиталями |
кДж/мо |
молекулы |
|||
атома |
нм |
(межвалентные |
ль* |
|||||
|
|
|
|
|||||
|
|
|
углерода |
|
углы)- |
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
C |
sp3 |
0,154 |
109° 28' |
350 |
Тетраэдричес |
|
|
|
кая |
||||||
|
|
|||||||
|
|
|
|
|
|
|
||
C |
|
C |
sp2 |
0,134 |
120° |
610 |
Плоскостная |
|
|
||||||||
|
||||||||
C |
|
C |
sp |
0,120 |
180° |
830 |
Линейная |
|
|
||||||||
|
||||||||
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
*Приведены средние значения энергий. |
|
|
||||
Направленность
Координационная связь, или донорно-акцепторная
|
|
|
донор |
|
акцептор |
|
|
|
A : + B |
A : B |
неподеленная пара электронов
9
|
|
H |
|
|
|
|
H |
|
+ |
||
H |
|
N : + H+ |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
|
|
|
H |
|
N : H |
|
|
||||
|
|
|
|
||||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
H |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
ион аммония
Семиполярная связь (от англ. semi — наполовину)
CH3 |
|
CH3 |
|
|
CH3 |
H3C N + O |
H3C |
N+ |
O- |
или |
H3C N O |
CH |
|
CH |
|
|
CH3 |
3 |
|
3 |
|
|
|
триметиламин |
|
оксид триметиламина |
|||
Водородная связь (H-связь) |
|
|
|
||
:O H |
:O |
H |
:O |
H |
:O H |
H |
H |
|
H |
|
H |
12,5—20 кДж/моль
Понятие о пространственном строении органических молекул
Конформации ациклических соединений
Проекция Ньюмена
|
H |
|
H H |
|
H |
C |
H |
H |
||
HH |
C |
|
|
|
|
H |
H |
|
H |
|
H |
H |
|
|
C |
H |
|
|
|
||
C |
|
|
H |
|
|
|
||||
|
|
|
|
|
|
|||||
H |
H |
|
H |
H H |
H |
|
H |
|
H |
|
|
|
|
||||||||
|
|
|
|
|||||||
|
|
|
|
|
|
H |
||||
|
|
|
|
|
|
|
|
|
||
Заслоненная конформация |
Заторможеная конформация |
|||||||||
Рис. |
9. |
Заслоненная |
и заторможенная |
конформации |
молекул |
|||||
этана и их ньюменовские проекционные формулы.

10
Торсионным, или диэдральным, углом называется угол между связями (в проекции Ньюмена), исходящими от атомов, связь между которыми является осью внутреннего вращения. Так, например, торсионный угол заслоненной конформации молекулы этана равен 0°, а заторможенной — 60°.
Рис. 10. Зависимость энергии конформации молекулы этана от торсионного угла.
|
CH3 |
|
H3C CH3 |
|
CH3 |
||
H |
|
H |
|
|
H |
|
CH3 |
H |
|
H |
H |
|
H |
|
H |
|
H |
H H |
|
||||
|
|
||||||
|
|||||||
|
|
CH3 |
|
H |
|||
|
анти |
|
син |
|
гош |
||
(антиперипланарная) (синперипланарная) |
(синклинальная) |
