
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
- •Вопрос 10
- •Вопрос 11
- •Вопрос 12
- •Вопрос 13
- •Вопрос 14
- •Вопрос 15
- •Вопрос 16
- •Вопрос 17
- •Вопрос 18
- •Вопрос 19
- •Вопрос 20
- •Вопрос 21
- •Вопрос 22
- •Вопрос 23
- •Вопрос 24
- •Вопрос 25
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •Вопрос 29
- •Вопрос 30
- •Вопрос 31
- •Вопрос 32
- •Вопрос 33
- •Вопрос 34
- •Вопрос 35
- •Вопрос 36
- •Вопрос 37
- •Вопрос 38
- •Вопрос 39
- •Вопрос 40
- •Вопрос 41
- •Вопрос 42
- •Вопрос 43
- •Вопрос 44
- •Вопрос 45
- •Вопрос 46
- •Вопрос 47
- •Вопрос 48
- •Вопрос 49
- •Вопрос 50
- •Вопрос 51
Вопрос 3
Дайте определение следующим понятиям: электронный слой, электронная оболочка, электронное облако, электронная орбиталь, узловая поверхность. Сколько максимально электронов может быть в …-слое, на … - оболочке?
Электронный слой (уровень) – совокупность электронов с одним и тем же значением главного кв. числа n. Максимальное число е в слое n: 2n2.
n=1: 1-ый слой или К-слой; n=2: 2-ой слой или L-слой; n =3: 3-ий слой или M-слой; и т.д
Электронная оболочка – совокупность эл-нов с одним и тем же значением побочного кв. числа l. Мак. число е в оболочке l: 2(2l+1). (2- число значений спинов).
l = 0 s-оболочка; l = 1 p-оболочка; l = 2 d-оболочка; l = 3 f-оболочка; l = 4 g-оболочка.
Электронная
орбиталь
– совокупность эл-нов с одним и тем же
значением магнитного кв. числа ml,
её обозначают □. При данном значении
l,
магнитное кв. число принимает значения:
 .
Общее число значений составляет (2l+1).
.
Общее число значений составляет (2l+1).
Узловой
поверхностей
орбитали наз. геометрическое место
течек, где волновая функции
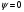 (
( ).
Узловые поверхности могут быть
сферическими, плоскими и коническими.
По определению каждая орбиталь имеет
сферическую узловую поверхность с
бесконечным радиусом. Главное кв. число
равно общему числу узловых поверхностей
данной орбитали.
).
Узловые поверхности могут быть
сферическими, плоскими и коническими.
По определению каждая орбиталь имеет
сферическую узловую поверхность с
бесконечным радиусом. Главное кв. число
равно общему числу узловых поверхностей
данной орбитали.
Вопрос 4
Принцип Паули и правило Хунда. Сколько максимально электронов может быть в электронном слое, электронной оболочке, на орбитали ? Какую форму имеют s-, p-, d- орбитали ?
Принцип Паули: в атоме не может быть двух электронов с одинаковым набором 4-х квантовых чисел.
Правило Хунда: суммарный спин электронов оболочки должен быть макссиммальным.
Максимальное число е в оболочке l: 2(2l+1).
Максимальное число е в слое n: 2n2.
Максимальное число на орбитали: 2е.
Формы s-, p-, d- орбиталей:
Вопрос 5
Энергия электрона в многоэлектронном атоме. Энергический ряд атомных орбиталей. Напишите электронные формулы атомов …, и иона …. Какие степени окисления может иметь … в соединениях?
Энергия электрона в атоме водорода (теория Бора) определяется единственным (главным) квантовым числом, а в многоэлектронном атоме – главным и орбитальным квантовыми числами. В целом энергия электрона возрастает по мере роста суммы названных квантовых чисел при доминирующем значении квантового числа. При одинаковой сумме энергия состояния с меньшим значением гл. кв. числа ниже. В соответствии с этими правилами энергетический ряд атомных орбиталей выглядит следующим образом:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p и т.д.
Вопрос 6
Современная формулировка периодического закона. Энергия ионизации и сродство к электрону, закономерности в их изменении по периодам и группам периодической системы.
Свойства химических элементов, а точнее свойства простых веществ, также формы и свойства образуемых ими соединений, находятся в периодической зависимости от величины заряда ядер их атомов.
Энергия ионизации - представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.
В целом в периоде в соответствии с тенденцией изменения атомных радиусов и увеличением притяжения электронов к ядру должна возрастать. Однако этот рост неравномерен.
Энергия, выделяющаяся при добавлении электрона к нейтральному атому, переходящему при этом в отрицательный однозарядный ион, наз. сродством к электрону. Сродство к двум или более электронам отрицательно. Наиболее часто энергию ионизации и сродство к электрону выражают в электроновольтах (эВ). 1 эВ = 1,60.10-19 Дж = 1,6.10-12 эрг.
Факторы, определяющие энергию ионизации (энтальпию ионизации):
1) эффект экранирования заряда ядра глубинными оболочками и слоями – уменьшение энергии ионизации атомов в подгруппе .
2) эффект проникновения внешних электронов к ядру. Согласно квантовой механике вероятность нахождения электрона в других слоях кроме «своего» не равна нулю. Этот эффект ведет к упрочнению связи электрона с ядром, т.е. к росту энергии ионизации, (самые проникающие s-электроны, менее – p и еще менее –d).
3) отталкивание электронов одного слоя, особенно находящихся на одной орбитали – уменьшение энергии ионизации.
Закономерности в их изменении по периодам и группам периодической системы:
По группе уменьшается, это обусловлено возрастанием расстояния электрона от ядра по мере увеличения размера атомов.
По периоду возрастает, это объясняется увеличением заряда ядра, но возрастание происходит неравномерно, эта закономерность вытекает из электронного строения (атомы с полностью заполненной внешней орбиталью обладают большей энергией ионизации)
