
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
- •Вопрос 10
- •Вопрос 11
- •Вопрос 12
- •Вопрос 13
- •Вопрос 14
- •Вопрос 15
- •Вопрос 16
- •Вопрос 17
- •Вопрос 18
- •Вопрос 19
- •Вопрос 20
- •Вопрос 21
- •Вопрос 22
- •Вопрос 23
- •Вопрос 24
- •Вопрос 25
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •Вопрос 29
- •Вопрос 30
- •Вопрос 31
- •Вопрос 32
- •Вопрос 33
- •Вопрос 34
- •Вопрос 35
- •Вопрос 36
- •Вопрос 37
- •Вопрос 38
- •Вопрос 39
- •Вопрос 40
- •Вопрос 41
- •Вопрос 42
- •Вопрос 43
- •Вопрос 44
- •Вопрос 45
- •Вопрос 46
- •Вопрос 47
- •Вопрос 48
- •Вопрос 49
- •Вопрос 50
- •Вопрос 51
Вопрос 42
Равновесие диссоциации комплексных соединений. Константа устойчивости и константа нестойкости. Реакции образования комплексных соединений. Приведите примеры получения гидроксокомплекса, амминокомплекса и ацидокомплекса.
Реакции образования комплексных соединений: комплексные соединения образуются и существуют в растворах при сравнительно большом избытке лиганда. Обычно его берут в несколько раз больше того количества, которое необходимо в соответствии со стехиометрическим соотношением. В результате подавляется диссоциация комплексного соединения, и оно стабилизируется.
Разная прочность связи во внутренней и внешней сферах комплексного соединения ведет к различию в характере диссоциации этих частей молекулы. По внешней сфере в водных растворах все комплексные соединения являются сильными электролитами, тогда как диссоциация по внутренней сфере происходит в незначительно степени.
K2[Zn(CN)4]
 2K+
+ [ Zn(CN)4]2-
; [Zn(CN)4]2-
2K+
+ [ Zn(CN)4]2-
; [Zn(CN)4]2-
 Zn2+
+ 4CN-
.
Zn2+
+ 4CN-
.
Константа
равновесия для последнего процесса
(диссоциация комплексного иона) называется
константой нестойкости: Кравн
= Кнест
=
 .
.
Константа
равновесия обратного процесса: Zn2+
+ 4CN-
 [Zn(CN)4]2-
наз. константой устойчивости: Кравн.
= Куст.
=
[Zn(CN)4]2-
наз. константой устойчивости: Кравн.
= Куст.
=
 .
.
Чем больше Куст. (меньше Кнест.), тем прочнее комплексное соединение, тем слабее оно диссоциирует. Ясно, что произведение Куст. и Кнест. равно единице.
Примеры:
Вопрос 43
Буферные растворы и их свойства. Расчет рН буферного раствора состава ….
Буферными растворами называют такие электролитные системы, рН которых не меняется при разбавлении и мало меняется при добавлении небольших количеств сильных кислот и оснований.
Буферные р-ры на кислую область – смеси растворов слабых кислот и их солей.
Буферные растворы на щелочную область – смесь водного раствора аммиака (NH4OH) и солей аммония.
Пусть
у нас р-р слабой одноосновной кислоты
и её соли (НА+NаА).
В р-ре имеются след. равновесия: НА
 Н+
+
А-
; NаА
Н+
+
А-
; NаА
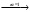 Nа+
+ А-
.
Nа+
+ А-
.
Наличие в р-ре ионов А- за счет полностью диссоциирующей соли NаА ведет к смещению равновесия диссоциации НА влево (подавлению и без того незначительной диссоциации кислоты НА). Пусть общая концентрация кислоты равна Скислоты; общая концентрация соли Ссоли; степень диссоциации кислоты α. Равновесие концентрации равны:
[А-] = Ссоли + [Н+] = Ссоли + α.Скислоты ≈ Ссоли ; так как: α<<1
[НА] = Скислоты − [Н+] = Скислоты – α.Скислоты ≈ Скислоты .
Константа
дисс. кислоты:
 . Отсюда:
. Отсюда:
 .
.
Как видно:
1) при разбавлении р-ра водной ведет к одинаковому уменьшению Скислоты и Ссоли , а отношение Скислоты/Ссоли не изменится и рН станет прежним.
2) добавим в буферный р-р несколько капель НСl, при этом часть соли NаА превратится в к-ту НА; в результате Скислоты немного возрастает, а Ссоли – уменьшится, а отношение Скислоты/Ссоли и соответственно рН буферного р-ра изменится мало.
3) Подобное произойдет при вливании в буферную смесь нескольких капель р-ра NаОН: Ссоли возрастает, Скислоты мало уменшится, а отношение Скислоты/Ссоли и соответственно рН буферного р-ра изменится мало.
