
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
- •Вопрос 10
- •Вопрос 11
- •Вопрос 12
- •Вопрос 13
- •Вопрос 14
- •Вопрос 15
- •Вопрос 16
- •Вопрос 17
- •Вопрос 18
- •Вопрос 19
- •Вопрос 20
- •Вопрос 21
- •Вопрос 22
- •Вопрос 23
- •Вопрос 24
- •Вопрос 25
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •Вопрос 29
- •Вопрос 30
- •Вопрос 31
- •Вопрос 32
- •Вопрос 33
- •Вопрос 34
- •Вопрос 35
- •Вопрос 36
- •Вопрос 37
- •Вопрос 38
- •Вопрос 39
- •Вопрос 40
- •Вопрос 41
- •Вопрос 42
- •Вопрос 43
- •Вопрос 44
- •Вопрос 45
- •Вопрос 46
- •Вопрос 47
- •Вопрос 48
- •Вопрос 49
- •Вопрос 50
- •Вопрос 51
Вопрос 40

 Шкалы
величин рН и рОН. Вычисление рН растворов
неассоциированных электролитов на
примерах ….
Шкалы
величин рН и рОН. Вычисление рН растворов
неассоциированных электролитов на
примерах ….
Вода
диссоциирует крайне незначительно:
2Н2О
 Н3О+
+ ОН-
;
Н3О+
+ ОН-
;
Для
простоты вместо гидроксония используют
негидратированный ион Н+,
т.к. это не влияет на последующие выводы:
Н2О
 Н+
+ ОН-
.
Н+
+ ОН-
.
Кравн. = [Н+][ОН-] = Kw – ионное произведение воды.
Замена активностей ионов на концентрации оправдана тем, что вода диссоциирует в очень незначительной степени. Действительно, при 298,15К концентрация ионов Н+ и ОН- в воде составляет 1*10-7моль/л (из 555 миллионов молекул воды диссоциирует лишь одна).
ΔG0процесса = ΔG0обрН+ + ΔG0обрОН- − ΔG0обрН2О(ж) = 0 – 157,32 − ( −237,25) = 79,93 кДж
Кw
=
 = 1,0*10-14;
[Н+][ОН-]=1,0*10-14
= 1,0*10-14;
[Н+][ОН-]=1,0*10-14
lg[Н+]
+ lg[ОН-]
= −14.
 − lg[Н+]
− lg[ОН-]
= 14; рН = −lg[Н+];
рОН = − lg[ОН-].
Отсюда: рН + рОН = 14.
− lg[Н+]
− lg[ОН-]
= 14; рН = −lg[Н+];
рОН = − lg[ОН-].
Отсюда: рН + рОН = 14.
Для любого водного р-ра при 298,15К: рН+ рОН=14. В воде в соответствии с уравнением ее диссоциации соответственно рН = рОH = 7, это нейтральная среда. В кислых растворах [Н+] > 10-7моль/л и рН < 7 (рОН>7). В щелочных растворах [Н+] < 10-7моль/л и рН>7 (рОН<7).
Получить растворы с большой концентрацией кислоты не представляет труда, например, Н2SO4 и НNO3 неограниченно растворимы в воде и можно приготовить их водные растворы практически любой молярной концентрации. Однако с ростом концентрации кислоты уменьшается степень ее диссоциации и в реальных системах получить растворы с концентрацией ионов водорода, большей 10 моль/л, практически невозможно. Учитывая это, получаем интервал изменения величин рН: −1 < pH < 15.
Вопрос 41
Равновесие диссоциации воды. Ионное произведение воды. Шкалы величин рН и рОН.
Вода
диссоциирует крайне незначительно:
2Н2О
 Н3О+
+ ОН-
;
Н3О+
+ ОН-
;
Для
простоты вместо гидроксония используют
негидратированный ион Н+,
т.к. это не влияет на последующие выводы:
Н2О
 Н+
+ ОН-
.
Н+
+ ОН-
.
Кравн. = [Н+][ОН-] = Kw – ионное произведение воды.
Замена активностей ионов на концентрации оправдана тем, что вода диссоциирует в очень незначительной степени. Действительно, при 298,15К концентрация ионов Н+ и ОН- в воде составляет 1*10-7моль/л (из 555 миллионов молекул воды диссоциирует лишь одна).
ΔG0процесса = ΔG0обрН+ + ΔG0обрОН- − ΔG0обрН2О(ж) = 0 – 157,32 − ( −237,25) = 79,93 кДж
Кw
=
 = 1,0*10-14;
[Н+][ОН-]=1,0*10-14
= 1,0*10-14;
[Н+][ОН-]=1,0*10-14
lg[Н+]
+ lg[ОН-]
= −14.
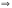 − lg[Н+]
− lg[ОН-]
= 14; рН = −lg[Н+];
рОН = − lg[ОН-].
Отсюда: рН + рОН = 14.
− lg[Н+]
− lg[ОН-]
= 14; рН = −lg[Н+];
рОН = − lg[ОН-].
Отсюда: рН + рОН = 14.
Для любого водного р-ра при 298,15К: рН+ рОН=14. В воде в соответствии с уравнением ее диссоциации соответственно рН = рОH = 7, это нейтральная среда. В кислых растворах [Н+] > 10-7моль/л и рН < 7 (рОН>7). В щелочных растворах [Н+] < 10-7моль/л и рН>7 (рОН<7).
Получить растворы с большой концентрацией кислоты не представляет труда, например, Н2SO4 и НNO3 неограниченно растворимы в воде и можно приготовить их водные растворы практически любой молярной концентрации. Однако с ростом концентрации кислоты уменьшается степень ее диссоциации и в реальных системах получить растворы с концентрацией ионов водорода, большей 10 моль/л, практически невозможно. Учитывая это, получаем интервал изменения величин рН: −1 < pH < 15.
